
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、普鲁士蓝简介
普鲁士蓝(PrUSSiAN BLuE,简称Pb),化学名称为亚铁氰化铁(Ferric Ferrocyanide)或六氰合铁(II)酸铁(III) (Ferric Hexacyanoferrate),又名柏林蓝(Berlin Blue)、中国蓝、华蓝(Chinese Blue)、巴黎蓝(Paris Blue)、米洛丽蓝、密罗里蓝 (Milori blue)、铁蓝(Iron Blue)、矿蓝(Mineral Blue)、颜料蓝27(Pigment Blue 27)、贡蓝等,是人类发现的第一个配位化合物。它作为一种性能优良的蓝色染料,广泛用于油漆、油墨、蜡笔、涂饰漆纸等着色。
二、普鲁士蓝的发现历程
德国柏林的涂料工人海因里希·狄斯巴赫(Heinrich Diesbach)的本职工作是用明矾提取胭脂虫中的胭脂虫红(Cochineal),加入硫酸亚铁并用固定碱处理使其沉淀。一天他的碱不够用了,便向炼金术士约翰·康拉德·迪佩尔(Johann Conrad Dippel)借了一些。与往常一样,在加入矾土后得到了白色的物质.但当他尝试蒸发浓缩的时候,他意外地发现沉淀物逐渐变成了深蓝色。他把这个现象告诉了迪佩尔,最后发现是迪佩尔之前反复用这种碱蒸馏一种“动物油(Animal Oil)”所导致的。在这个过程中,牛血(Bullock's Blood)(含碳、氮)通过焙烧进入碱液(草木灰,含K2CO3)中,得到黄血盐。这种蓝颜料很快被大量制备并投入使用,根据其发源地被命名为“普鲁士蓝”或“柏林蓝”。普鲁士军队的制服使用的就是这种颜色。
三、黄血盐VS赤血盐
顾名思义,黄血盐是黄色的,赤血盐是深红色的,他们是由不同价态铁的氰配合物形成的稳定的钾盐。

左为黄血盐,右为赤血盐
1.黄血盐
亚铁氰化钾(potassium ferrocyanide)或六氰合铁(II)酸钾(potassium hexacyanoferrate),俗名黄血盐,化学式为K4[Fe(CN)6],其中铁元素显+II氧化态。黄血盐不易水解,可由Fe2+与KCN反应制备:
Fe2++2CN- ====Fe(CN)2↓
Fe(CN)2+4CN- ====[Fe(CN)6]4-
黄血盐易被氧化剂氧化为赤血盐:
[Fe(CN)6]3- + e-====[Fe(CN)6]4- E⊖=0.358 V
相比之下,Fe3++e-====Fe2+ E⊖=0.771 V
2.赤血盐
铁氰化钾(potassium ferricyanide)或六氰合铁(III)酸钾(potassium hexacyanoferrate(III)),俗名赤血盐,化学式为K3[Fe(CN)6],其中铁元素显+III氧化态。赤血盐会发生微弱的水解反应,使得赤血盐毒性比黄血盐大:
[Fe(CN)6]3-+3H2O====Fe(OH)3↓+3CN-+3HCN
E⊖([Fe(CN)6]3-/[Fe(CN)6]4-)不随pH的改变而改变,赤血盐在碱性条件下有较强氧化性。
四、普鲁士蓝VS滕氏蓝
普鲁士蓝由德国人狄斯巴赫所发现,而滕氏蓝(Turnbull's Blue,简称TB),则是一种来自东方的蓝。普鲁士蓝和滕氏蓝都可作为蓝色颜料使用。由于普鲁士蓝的蓝色更深、原料更易得等原因而更受亲睐。

普鲁士蓝可由Fe3+与黄血盐反应制得,而滕氏蓝由Fe2+与赤血盐反应制得。如果按照复分解反应来看,那么应该是:
4Fe3++3[FeII(CN)6]4-====FeIII4[FeII(CN)6]3↓(普鲁士蓝)
3Fe2++2[FeIII(CN)6]3-====FeII3[FeIII(CN)6]2↓(滕氏蓝)
如果对比铁与氰基的比例,可以发现不溶性普鲁士蓝(insoluble prussian blue)和滕氏蓝的化学式并不相同。但前人对它们做了许多研究,如单晶x射线衍射(Single crystal X-Ray Diffraction)、中子衍射(neutron diffraction)[4]、氧化电势(oxidization potential)的测量、顺磁磁化率(paramagnetic susceptibility)的测定、声子吸收光谱(phonon absorption spectrum)和穆斯堡尔谱(mössbauer spectrum)等方法,最终表明它们其实具有相同的结构,均为FeIII4[FeII(CN)6]3·xH2O(x=14~16)。这样便能使不溶性普鲁士蓝和滕氏蓝拥有相同的化学式:
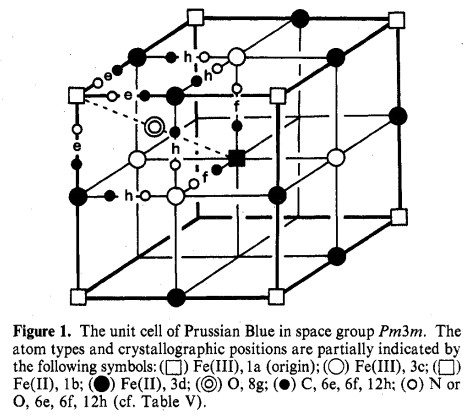
(图注:Pm3m(空间群下的普鲁士蓝)。上述符号部分地表示了原子类型和晶体位置)
曾经认为普鲁士蓝的颜色是通过两种价态铁之间的共振实现的,但梅尔文·B·罗宾(Melvin B. Robin)通过量子力学的计算否定了这种观点。实际上,低自旋的Fe(II)与高自旋的Fe(III)之间电荷转移(charge-transfer)吸收可见光,形成蓝色。而通过对穆斯堡尔谱的解析,上式中的FeII3[FeIII(CN)6]2(铁氰化亚铁)被认为是滕氏蓝的前体物质或普鲁士蓝的电子激发态,而非滕氏蓝。
不过,华中师范大学祝心德等三位教授重新研究了两者的穆斯堡尔谱,并认为普鲁士蓝和滕氏蓝是两种不同的物质。他们推断普鲁士蓝和滕氏蓝有相同的晶体结构和外接离子位置,只是它们的电子结构不同。对于普鲁士蓝为什么比滕氏蓝颜色更深,他们给出了两种合理的解释:一是在氰配合物中,中心离子FeIII比FeII的分裂能ΔO更大,发生d-d跃迁时吸收光的波长更短,颜色更浅,因此由含[FeIII(CN)6]3-的赤血盐制得的滕氏蓝比由含[FeII(CN)6]4-的黄血盐制得的普鲁士蓝颜色更浅。二是经过他们的计算机拟合,滕氏蓝存在Fe2+与邻近[FeIII(CN)6] 3-之间的电子跃迁而普鲁士蓝中不存在,这也表明滕氏蓝电子跃迁所需能量大,颜色浅。
除了不溶性普鲁士蓝和滕氏蓝,还有一种以胶体的形式存在的可溶性普鲁士蓝(soluble prussian blue, KFeIII[FeII(CN)6])或称亚铁氰化铁钾(potassium ferric ferrocyanide)或六氰合铁(II)酸铁(III)钾(potassium ferric hexacyanoferrate)[8],将黄血盐与铁盐混合即可得到。唯一的制法区别是,如若Fe3+过量,则得到不溶性普鲁士蓝。
K++Fe3++[FeII(CN)6]4-====KFeIII[FeII(CN)6]
在可溶性普鲁士蓝的结构中,K+占据一半(实际超过一半)的1/8晶胞空隙且两两不相邻(未画出),Fe(II)与Fe(III)通过氰基两端紧密桥联:
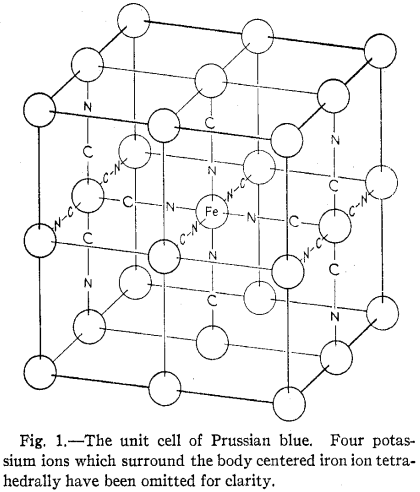
图注:(可溶性)普鲁士蓝晶胞。为清晰起见,体心处铁离子周围的呈四面体分布的四个钾离子被省略。
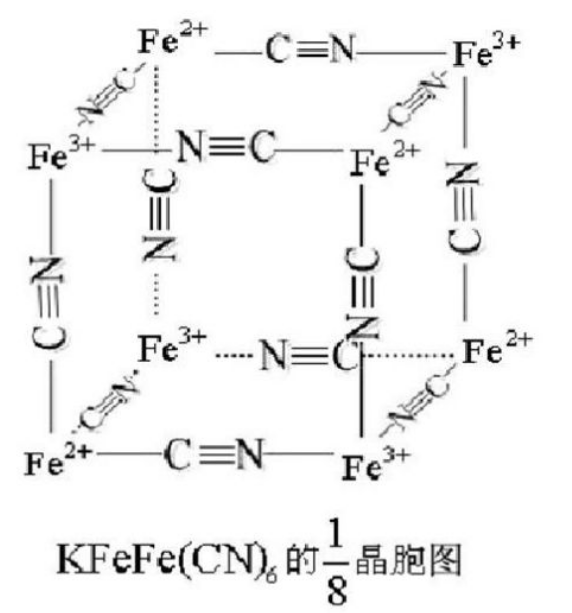
可溶性普鲁士蓝KFeIII[FeII(CN)6]的1/8晶胞图
五、柏林白VS柏林绿
在大一“元素及化合物性质(二)”实验中,如果你别有用心的话,将Fe2+与黄血盐混合、Fe3+与赤血盐混合,不出意外,也都会得到沉淀物。其中,Fe2+与黄血盐反应得到白色沉淀柏林白(Berlin White, FeII2[FeII(CN)6]或K2FeII[FeII(CN)6])、威廉姆斯白(Williamson's White)、普鲁士白(Prussian White)或埃弗里特盐(Everitt's Salt),即亚铁氰化亚铁(ferrous ferrocyanide)或亚铁氰化亚铁钾(potassium ferrous ferrocyanide);Fe3+与赤血盐反应得到绿色沉淀柏林绿(Berlin Green, FeIII[FeIII(CN)6])或普鲁士棕(Prussian Brown)经部分氧化形成的普鲁士绿(Prussian Green)(类似于氢氧化亚铁的氧化),即铁氰化铁(Ferric Ferricyanide)。
如果你还有印象的话,狄斯巴赫最开始得到的白色物质便是柏林白。当他蒸发浓缩的时候,柏林白中4/7的Fe(II)被空气中的氧气氧化为Fe(III),于是便形成了普鲁士蓝。
柏林白和柏林绿没有普鲁士蓝和滕氏蓝颜色那么深,原因就是在于它们之中铁元素具有相同的价态,不易发生电荷的转移。
六、普鲁士蓝的其它用途
除了用作性能优良的蓝色染料,普鲁士蓝还有许多其它用途逐渐被人们发现,尤其是普鲁士蓝纳米颗粒在医学、材料学等领域更是前景广阔,近年来相关文献不计其数。下面仅简要介绍其两种重要用途,余者还请读者自行查阅有关文献。
1.治疗铊中毒和排除放射性铯
普鲁士蓝中的铁与氰基结合得足够紧密,剧毒的氰根离子几乎不可能游离出来,因此普鲁士蓝本身是无毒的。可溶性普鲁士蓝有一半的晶胞空隙中填充了钾离子,在剧毒的铊离子(Tl+)浓度较高时,会将普鲁士蓝中多余的钾离子置换出来(而不是填充剩余空隙),从而降低铊离子浓度,达到解毒的目的。
1994年11月24日起,清华大学学生朱令出现中毒症状,经诊断疑似两次摄取致死剂量的铊。经服用普鲁士蓝后,体内的铊被逐渐排出,但由于确诊时间过长,错过了宝贵的治疗时间,医生们虽然尽全力挽回了朱令的生命,但她却成了“植物人”。案件至今仍未破解。
与排除体内铊的作用机制相似,普鲁士蓝也能对与铊离子半径相近的铯离子(Cs+)有吸附作用。因此,普鲁士蓝也被用来修复被铯的放射性同位素铯-137污染的环境,和促进排除辐射病患者体内的放射性铯。
2.用作普鲁士蓝基修饰电极传感器
在氧化酶的作用下,许多生物小分子能被氧气氧化为水和二氧化碳等物质,但其中不免有少量过氧化氢的产生。过氧化氢浓度与酶底物浓度成正比,因此通过检测过氧化氢浓度即可反映出氧化反应进行的程度。传统方法中电极所需电势较高,许多易氧化的物质参与反应会干扰测量结果。阿贝尔卡德·布瓦耶(Abelkad Boyer)等人首先研究了普鲁士蓝修饰碳糊电极(prussian-blue-modified carbon paste electrode),较好地解决了这个问题。
鉴于普鲁士蓝电催化剂相比于铂能更好地催化过氧化氢的还原反应,采用普鲁士蓝基修饰电极的第一代电流型葡萄糖生物传感器(prussian blue-based first-generation biosensor)横空出世。它对工作电极的电势要求更低,这减小了还原剂对传感器响应的影响。过氧化氢的氧化作用可监测其响应。通过比较不同酶电极上阴阳极信号,找到最佳条件,就可以逐步提升生物传感器的选择性。
利用普鲁士蓝优良的磁、电和光学性质,也可以制造出许多种其它的生物传感器,它们有寿命长、pH稳定性高等诸多优点。
七、结语
普鲁士蓝与其它无机物和有机物相比拥有极其特殊的结构特征,它一定还有许多未知的性质和用途等待我们去不断探索、不断发掘。在这蓝蓝的夜色笼罩下,让我们亲手揭开普鲁士蓝的这层神秘面纱,去寻找属于我们的蓝蓝的梦幻吧!

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
一、普鲁士蓝简介 普鲁士蓝(Prussian blue,简称PB),化学名称为亚铁...
...
近日看见一些老师讨论黄铜矿中Fe价态,觉得一些老师可能会有...
清洗银器 黑银是由于氧化所致,氧化银(Ag 2 O)是黑色的故银的表...
金(gold)一种化学元素,符号是Au,荷电核数为79,原子量为1...
先讲一个问题,天然碱式碳酸铜没有固定的化学组成?天然的碱...