
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
活泼金属Mg和H2O之间的反应不明显。一般认为是由于Mg(OH)2溶解度小,包裹在Mg表面,从而阻碍内层Mg和H2O的接触。
Mg+2H2O→Mg(OH)2+H2
若给反应体系适当加热,有助于Mg(OH)2溶解,冷却后溶液能使酚酞指示剂显色。
若把Mg置于NH4Cl(~1mol/L)溶液中,可以看到有显著量H2的生成。一般认为这是由于NH4Cl液的酸性溶解Mg(OH)2之故,使“内层”Mg能继续和H2O发生反应。这种观点,显然是把Mg(OH)2当作中间物。
为了考察以上看法是否属实,特设计以下2个实验。
实验1
往NH4Cl溶液中滴加酚酞,放入表面已经擦干净的Mg带。如果实验现象只是在酚酞变色前,Mg在NH4Cl溶液中不断释出H2,以上看法还是可以接受的;如果在酚酞变色后,Mg在铵盐水溶液中仍能不断地释出H2,那么上述观点[酸性和Mg(OH)2的反应]观点就有疑问了,至少是酚酞变色后的生H2反应不宜再用NH4Cl溶液的酸性和Mg(OH)2作用来解释。
实验现象是:
Mg在NH4Cl溶液中明显生成H2,溶液变成红色后,(注:所用NH4Cl越浓,则生H2速度越快,但溶液使酚酞变色所需时间越长。一般用~1mol/L NH4Cl溶液能较好地兼顾以上两个方面),仍能明显生成H2,此时若再强调NH4Cl溶液的酸性就不妥了。目前的看法是:Mg(OH)2是中强碱,碱性强于NH3·H2O,所以就发生了“强”碱替换弱碱的反应(生成NH3·H2O使酚酞变色):
Mg(OH)2 + 2NH4+→Mg2++ 2NH3·H2O
因此,只要有NH4+存在(不论是酸性或碱性)就能发生上述反应。
实验2把表面擦净的Mg条放入含有几滴酚酞的NaCl(~1mol/L)溶液中,可观察到Mg带表面不断释出H2。不久溶液变红(若未擦净Mg的表面,则在放入NaCl后不久,溶液即变成红色。这是Mg表面MgO、Mg3N2和水反应生成Mg(OH)2、NH3·H2O所致)。溶液变红后,Mg仍能在NaCl水溶液中不断生成H2。
目前认为,这是NaCl能破坏Mg表面膜之故。关于NaCl破坏表面膜的机理,目前尚无统一的看法,也不是本书要讨论的问题。
以上两个实验结果表明,利用酸性固然可以破坏Mg表面的膜,而非酸性的盐也能破坏Mg表面的膜。其实能破坏Mg表面膜的强电解质有的是,如把擦净的Mg带分别放入NaBr、NaNO3溶液(~1mol/L,起始溶液均是中性),再加几滴酚酞,也能观察到有H2的生成并使溶液变成红色,此后仍能生成H2。
和Mg在NaCl溶液中反应现象的区别仅仅是生H2速度较慢,使溶液变色所需时间较长(在NaNO3溶液中生H2速度更慢,变色所需时间更长)。也就是说,NaCl破坏Mg表面膜的能力最强,NaNO3最弱。由于三者都是钠盐,浓度又相近,可认为破坏镁表面膜能力最强的是Cl-的作用(当然,也不能因此认为只有Cl-在起作用)。
现在再回过头来讨论Mg和NH4Cl溶液的反应。如上所说相应的方程式是
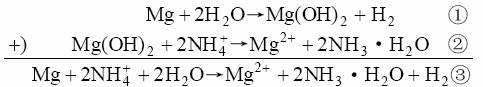
从化学平衡角度看,书写③式和书写①式和②式是等效的,应该说没有任何区别。然而,两种写法却出现了难于判断的情况:按①式和②式书写时,反应中无疑Mg是还原剂,而H2O是氧化剂;然而按③式书写时,Mg仍是还原剂,但氧化剂既可能是H2O,也可能是NH4+。按一般常理,人们判定NH4+是氧化剂的可能性较大。若承认H2O是氧化剂,事实上就等于说Mg(OH)2是这个反应的中间物;若NH4+是氧化剂,就等于说Mg和NH4+直接反应,而不必经过中间物Mg(OH)2。遗憾的是,Mg(OH)2中间物(在这个反应中)是否存在,至今尚无实验能证明。因此,也就很难肯定究竟是H2O或是NH4+或两者都是氧化剂。这是一个至今尚未解决的问题,只是在不同书写时使之表现出来而已。
类似问题是很多的,只是未意识、未曾发现而已。如有一种观点认为:
Al和NaOH溶液作用反应式的配平“必须是”Al丢失的电子为氧化剂H2O所获得。
2Al + 6H2O→2Al(OH)3 + 3H2
Al(OH)3 + OH-→Al(OH)4-
不言而喻,此种说法表明:Al(OH)3一定是反应的中间物。但当讨论Al和酸作用时,则认为Al丢失的电子被H+获得,而不需经过中间物Al(OH)3。
2Al + 6H+→2Al3++ 3H2
问题仍然发生在究竟Al(OH)3是否是中间物。遗憾的是,在以上两个实验中至今尚无法证实Al(OH)3、Mg(OH)2是否存在。有人可能会提出,能否从反应速度快慢给予判断。言下之意,反应经历的步数多,反应速度就慢。事实上,Al和酸、碱反应的速度都比较快,何况即使速度快慢不同,也不是反应经历步数多少的必然反映(如读者熟悉的H2 + Cl2 = 2HCl反应速度很快,却是个多步反应)。Al和NaOH反应时究竟是H2O或OH-或两者都是氧化剂,不得而知,但从化学热力学观点讨论,提出首先生成中间物Al(OH)3、Mg(OH)2则是允许的,因为化学热力学是研究反应终态和起始态之间关系而置动力学于不顾的一门学问。希望读者充分注意,在用热力学观点讨论问题时可能出现类似的情况,不要把尚无实验证据的、人为的观点强加于反应过程。为此,再举几个常见的实例。
在冷、浓HNO3中,Al因表面生成保护膜而钝化。无疑这种观察是有实验根据的。把经过钝化的Al置于热、浓HNO3液中,因保护膜溶解而使Al能持续地和热、浓HNO3反应。此时,持续反应过程的机理是:Al直接和热浓HNO3反应呢,还是Al表面再生成保护膜,保护膜再溶解,再钝化……或者两者兼而有之。没有实验证据。一般认为前者历程是可信的,因在热、浓HNO3中Al不可能形成保护膜。
Pb可作为耐酸材料,这是由于它和一般浓度HCl、H2SO4作用时表面形成难溶的PbCl2、PbSO4,致使Pb有耐酸的性能。但在浓HCl中,因生成溶解度较大的PbCl42-,而不耐浓HCl腐蚀;同理,在浓H2SO4中,因生成溶解度稍大的Pb(HSO4)2而不耐浓H2SO4的腐蚀。在Pb不耐浓HCl、浓H2SO4腐蚀的实验中,究竟是Pb直接和浓HCl、浓H2SO4反应,还是首先生成PbCl2、PbSO4,而后再形成PbCl42-、Pb(HSO4)2或者两者兼而有之,尚不清楚。一般认为前者较为可信,既然能直接生成PbCl42-、Pb(HSO4)2,又何必借助于PbCl2、PbSO4呢!即便如此,这仍然是一种观点而已。
Pb + 4HCl→H2PbCl4 + H2
Pb + H2SO4→Pb(HSO4)2 + H2
再次强调指出,虽存在上述不确定性,但从热力学观点提出Mg(OH)2等是中间物则是允许的,特别是在许多教科书中为同类问题按其共性统一起来,介绍时所提出的一些观点。希望读者注意其前提(是化学热力学,还是化学动力学)、观点和一定过程相联系(如H2O是氧化剂和中间物Mg(OH)2相联系)。不要把在一定前提下所得到的结果“绝对化”。在应用有关结论时若违背了或不注意前提,得不到正确的结论是常有的事。
这类实验事实还表明:即使是很简单的基本问题,至今尚有许多不完全清楚的情况,学习化学的兴趣就在于此。已故著名化学家傅鹰教授曾经说过:“如果学生听了我的课,认为化学中的问题都已经解决了,那么我的课就完全、彻底地失败了”。这是多么深刻的观点。看来,只学习成熟的理论、已知的事实是不够的,还要我们去探索未曾解决、没有结论的问题。在探索的过程中,实验是很重要(也许可以说是最重要)的一个环节。轻视化学实验不可能学好化学,则是确定无疑的事实。不顾实验事实,任意提出看法是不正确的方法。随着研究的深入,完全可能出现否定在今天看来是正确的观点和理论的情况。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
一、普鲁士蓝简介 普鲁士蓝(Prussian blue,简称PB),化学名称为亚铁...
...
近日看见一些老师讨论黄铜矿中Fe价态,觉得一些老师可能会有...
清洗银器 黑银是由于氧化所致,氧化银(Ag 2 O)是黑色的故银的表...
金(gold)一种化学元素,符号是Au,荷电核数为79,原子量为1...
先讲一个问题,天然碱式碳酸铜没有固定的化学组成?天然的碱...