
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
AlCl3是共价化合物,在气态时是双聚分子,化学式为Al2Cl6,氯化铝其中一个氯和和另一个氯化铝中的铝形成配位键,如图所示,每个铝周围都达到8个电子 :
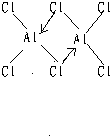
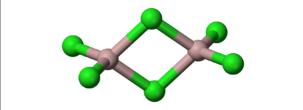
这是因为离子键是正负电荷的吸引,共价键是电子云的重叠。三价铝离子半径过小,电荷过高,产生的电场强,即极化能力强,氯的电子云在电场作用下变形,和铝的电子云重叠,形成共价键。固体AlCl3上温度上升至150度时即可气化成Al2Cl6。在高温下离解为平面型的AlCl3。
再者,从电负性上分析,成键的两个原子的电负性之差大于1.7的就认为是离子键,小于1.7的就认为属于共价键。Al与Cl的电负性之差都小于1.7,所以认为它们也属于共价化合物。符合这种情况的还有BeCl2,Be与Cl电负性之差也小于1.7,也属于共价化合物。
在高中阶段,其实不用给学生分析AlCl3为什么是共价化学物而不是离子化合物。只要求他们把AlCl3为共价化合物作为一个特殊的例子来记忆就得了。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
说明:本文介绍了化学键的本质及其分类。文章详细介绍了价键...
手性碳原子 是指人们将连有四个不同基团的碳原子形象地称为手...
补充:...
手性分子不一定含有手性碳原子。 判断分子是否具有手性的黄金...
冠醚是一类大环多醚化合物,其分子结构呈环状,环上均匀分布...
在高考备考化学试卷里,经常会遇到含钯的催化剂。本文将就钯...