
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、元素金属性、非金属性强弱的判断方法有哪些?
1.元素金属性强弱的判断方法
本质:原子越易失电子,则金属性就越强。
(1)根据元素周期表进行判断:
同一周期:从左到右,随着原子序数的递增,元素的金属性逐渐减弱。
同一主族:从上到下,随着原子序数的递增,元素的金属性逐渐增强。
(2)一般情况下,在金属活动性顺序中越靠前,金属性越强。如Zn排在Cu的前面,则金属性:Zn>Cu。
(3)根据金属单质与水或者与酸(非氧化性酸如盐酸、稀硫酸等)反应置换出氢气的难易程度。置换出氢气越容易,则金属性就越强。如Zn与盐酸反应比Fe与盐酸反应更易置换出氢气,则金属性:Zn>Fe。
(4)根据金属元素最高价氧化物对应水化物碱性的强弱。碱性越强,则原金属单质的金属性就越强。如碱性NaOH>Mg(OH)2,则金属性:Na>Mg。
(5)一般情况下,金属单质的还原性越强,则元素的金属性就越强;对应金属阳离子的氧化性越强,则元素的金属性就越弱。如还原性Na>Mg,则金属性:Na>Mg,氧化性:Na+<Mg2+。
(6)水溶液中的置换反应:如Zn+Cu2+=Zn2++Cu,则金属性:Zn>Cu。
特别提醒
①一般来说,在氧化还原反应中,单质的氧化性越强(或离子的还原性越弱),则元素的非金属性就越强;单质的还原性越强(或离子的氧化性越弱),则元素的金属性就越强。故一般来说,元素的金属性和非金属性的强弱判断方法与单质的氧化性和还原性的强弱判断方法是相一致的。
②金属性强弱的比较,是比较原子失去电子的难易,而不是失去电子的多少。如Na易失去1个电子,而Mg易失去2个电子,但Na的金属性更强。
2.元素非金属性强弱的判断方法
本质:原子越易得电子,则非金属性就越强。
(1)根据元素周期表进行判断:
同一周期:从左到右,随着原子序数的递增,元素的非金属性逐渐增强。
同一主族:从上到下,随着原子序数的递增,元素的非金属性逐渐减弱。
(2)非金属元素单质与H2化合的难易程度:化合越容易,非金属性越强。如F2与H2在黑暗中就可反应,Br2与H2在加热条件下才能反应,则非金属性:F>Br。
(3)形成气态氢化物的稳定性:气态氢化物越稳定,元素的非金属性越强。如稳定性:HF>HCl,则非金属性:F>Cl。
(4)最高价氧化物对应水化物的酸性强弱:酸性越强,对应非金属元素的非金属性就越强。如酸性:HClO4>HBrO4,则非金属性:Cl>Br。
(5)一般情况下,非金属单质的氧化性越强,则元素的非金属性就越强;对应阴离子的还原性越强,则元素的非金属性就越弱。如氧化性Cl2>Br2,则非金属性:Cl>Br。
(6)水溶液中的置换反应:如Cl2+2Br-=2Cl-+Br2,则非金属性:Cl>Br。
(7)根据与某变价金属反应,生成化合物中金属元素的化合价的高低进行判断。
二、怎样比较微粒半径大小?
影响微粒半径大小的因素主要有:①电子层数的多少;②原子核对核外电子的吸引力的大小;③核外电子数的多少。
1.原子
(1)同一周期,从左到右,核电荷数依次增大,原子半径依次减小。
如:r(Na)>r(Mg)>r(Al)>r(Si)>r(P)<r(s)>r(Cl)。
(2)同一主族,自上而下,电子层数依次增多,原子半径依次增大。
如:r(Li)<r(Na)<r(K)<r(Rb)<r(Cs)。
2.离子
(1)同一主族,自上而下,电子层数依次增多,离子半径依次增大。
如:r(Li+)<r(Na+)<r(K+)<r(Rb+)<r(Cs+)。
(2)具有相同电子层结构的离子,随核电荷数的增大,离子半径减小。
如:r(O2-)>r(F-)>r(Na+)>r(Mg2+)。
3.同一元素的不同微粒,核外电子数越多,半径越大。
(1)阳离子:r(原子)>r(阳离子)。
如:r(Na)>r(Na+)。
(2)阴离子:r(原子)<r(阴离子)。
如:r(Cl)<r(Cl-)。
(3)多种价态的离子:价态越高,半径越小。
如:r(Fe)>r(Fe2+)>r(Fe3+)。
3、怎样进行元素的推断?
元素推断题在历年高考中占有一定的比例(主要在选择题中体现),主要考查元素周期表中“位、构、性”的关系及利用物质结构和性质进行综合推断的能力,要求熟练掌握短周期所有元素的结构特点、在周期表中的位置以及它们的重要化合物的性质,在此基础上进行综合分析。
1.一般解题思路
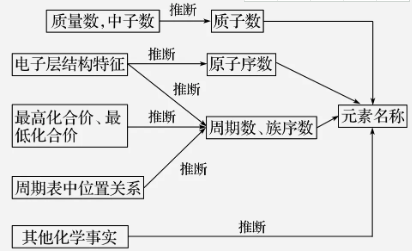
在以上基础上,针对题目按以下具体方法进行推断:
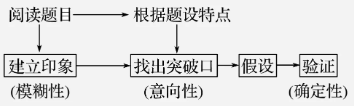
2.推断方法
(1)对于简单的推断题只要应用有关知识点进行直接判断、比较或计算,即可找到答案。
(2)很多情况下只涉及短周期元素或前20号元素,可在草稿纸上画出一个只包含短周期或前20号元素的周期表,对照此表进行推断。
(3)可利用题目暗示的突破口,联系其他条件,顺藤摸瓜,各个击破,推出结论。
①对无明显突破口的元素推断题,可利用题示条件的限定,逐渐缩小范围,并充分考虑各元素的相互关系。
②有时限定条件不足,则可进行讨论,得出合理结论,有时答案不止一组,只要合理就可以;若题目只要求一组,则选择自己最熟悉、最有把握的。
③有时需要运用直觉,大胆尝试、假设,再根据题给条件进行验证。
同时这类试题关联性很强,如有不慎,一种元素推断错误,往往全盘皆输,因此一定要仔细,不要忘记将推出的元素代入试题中检验,以免出现不必要的错误。这类试题一般是通过化学基本用语回答相关问题,为此回答问题要简洁明确。
3.推断常见“突破口”
(1)原子结构与元素在周期表中位置关系的规律
①核外电子层数=周期数。
②主族元素的最外层电子数=主族序数。
③质子数=原子序数=原子核外电子数。
④主族元素的最高正化合价=主族序数(F、O除外);最低负化合价的绝对值=8-主族序数。
(2)主族元素在周期表中的特殊位置
①族序数等于周期数的元素:H、Be、Al。
②族序数等于周期数2倍的元素:C、S。
③族序数等于周期数3倍的元素:O。
④周期数是族序数2倍的短周期元素:Li。
⑤周期数是族序数3倍的短周期元素:Na。
⑥最高正价与最低负价代数和为零的短周期元素:C、Si。
⑦最高正价是最低负价绝对值3倍的短周期元素:S。
⑧除H外,原子半径最小的元素:F。
⑨最高正价不等于族序数的短周期元素:O、F。
(3)主族元素性质、存在和用途的特殊性
①形成化合物最多的元素(或单质是自然界硬度最大的元素、气态氢化物中氢的质量分数最大的元素):C。
②空气中含量最多的元素或气态氢化物的水溶液呈碱性的元素:N。
③氢化物在通常状况下呈液态的元素:O。
④最活泼的非金属元素(或无含氧酸的非金属元素、其无氧酸可腐蚀玻璃的元素、其气态氢化物最稳定的元素、阴离子的还原性最弱的元素):F。
⑤最高价氧化物对应水化物酸性最强的元素:Cl。
⑥最易着火的非金属元素的单质,其元素是:P。
⑦最轻单质所含的元素:H;最轻金属单质所含的元素:Li。
⑧单质常温下呈液态的元素:Br和Hg。
⑨最高价氧化物及其水化物既能与强酸反应,又能与强碱反应的元素:Al。
⑩元素的气态氢化物和它的最高价氧化物的水化物起化合反应的元素:N。
⑪元素的单质在常温下能与水反应放出气体的短周期元素:Li、Na、F。
⑫常见的能形成同素异形体的元素:C、P、O、S。
提醒:核外电子总数相等的微粒可以是分子,也可以是离子;可以是单核微粒,也可以是多核微粒。电子总数相同的微粒:
(1)核外有10个电子的微粒
分子:Ne、HF、H2O、NH3、CH4
阳离子:Na+、Mg2+、Al3+、H3O+、NH4+
阴离子:N3-、O2-、F-、OH-、NH2-
(2)核外有18个电子的微粒
分子:Ar、HCl、H2S、PH3、SiH4、F2、H2O2、N2H4、C2H6等
阳离子:Ca2+、K+
阴离子:P3-、S2-、Cl-、HS-
(3)核外电子总数及质子总数均相同的粒子
Na+、NH4+、H3O+;F-、OH-、NH2-;Cl-、HS-;N2、CO等
4、化学键类型与物质类别之间的有怎样的关系?
1.化学键类型与物质类别间的关系图
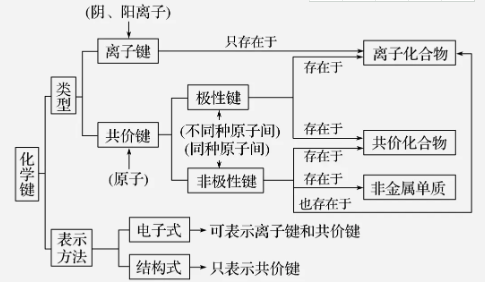
2.化学键类型与物质类别关系的判定规律
(1)含有离子键的物质一定是离子化合物,因为离子化合物是由阴、阳离子结合而成的。
(2)第ⅠA、第ⅡA族的金属元素的单质与第ⅥA、第ⅦA族的非金属元素的单质发生反应时,一般通过离子键结合而形成离子化合物。
(3)金属阳离子与某些原子团(如NO3-、CO32-、SO42-、OH-等)之间,通过离子键而形成离子化合物。
(4)多种非金属元素之间可能形成离子键,常见的是铵盐,如NH4Cl、(NH4)2S等。
(5)离子化合物中可能含有共价键(极性或非极性共价键),如NaOH、Na2O2。
(6)只含极性共价键的物质一定是共价化合物,如HCl、H2SO4、H2O等。
(7)只含非极性共价键的物质一定是非金属单质,如N2、H2、Cl2等。
(8)共价化合物中一定不含有离子键,可能含有非极性共价键。
注意:稀有气体单质中不存在化学键;多原子单质分子中存在共价键;非金属化合物分子中存在共价键(包括酸);离子化合物中一定存在离子键,可能有共价键的存在(Na2O2、NaOH、NH4Cl);共价化合物中不存在离子键;离子化合物可由非金属元素构成,如:NH4NO3、NH4Cl等。
5、怎样辨别离子化合物与共价化合物?
1.离子化合物
只要含有离子键,该化合物就可以称之为“离子化合物”。例如:大部分盐(包括所有铵盐)、强碱、大部分金属氧化物、金属氢化物。
常见的能形成离子键的原子或原子团为
(1)由活泼金属元素与非金属元素化合,例如:CaCl2、NaOH、NaH等。
(2)由金属离子(或NH4+)与酸根离子形成,例如:Na2CO3、NH4Cl、KNO3、BaSO4等。
2.共价化合物
只含有共价键的化合物才可以称之为“共价化合物”。例如:非金属氧化物、酸、弱碱、少部分盐、非金属氢化物等。
常见的形成共价键的原子或原子团为
(1)由非金属原子间形成单质或化合物时形成共价键,例如:Cl2、CCl4、H2O、HF等。
(2)常见的原子团内含有共价键,例如:CO32-、SO42-、NO3-、NH4+、OH-、O22-等。
提醒 (1)金属元素与活泼的非金属元素形成的化合物不一定都是以离子键结合的,如AlCl3则是通过共价键结合的。
(2)非金属元素之间也可形成离子化合物,如铵盐(NH4Cl、NH4NO3等)都是离子化合物。
(3)构成稀有气体的单质分子,由于原子已达到稳定结构,在这些单原子分子中不存在化学键。
3.离子化合物和共价化合物的判断方法
(1)根据构成化合物的微粒间是以离子键还是以共价键结合判断。一般说来,活泼的金属原子和活泼的非金属原子间形成的是离子键,同种或不同种非金属原子间形成的大多是共价键。
(2)根据化合物的类型来判断。大多数碱性氧化物、强碱和盐等都属于离子化合物;非金属氢化物、非金属氧化物、含氧酸等都属于共价化合物。
(3)根据化合物的性质来判断。熔点、沸点较低的化合物大多是共价化合物。熔化后不能发生电离的化合物是共价化合物,熔融状态下能导电的化合物是离子化合物。
因此,在离子化合物中一定含有离子键,但也可能含有共价键,共价化合物中一定不存在离子键,肯定存在共价键。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
...
1.有关电离能的考点的答题模板 ①氮元素的第一电离能比同周期...
...
知识要点 1.电子运动状态的各种特征(以Mn为例,1s 2 2s 2 2p 6 3s ...
一. 解题要领 解题步骤 解题策略 首尾呼应 找出主线 1. 对照原料...
一、物质结构常见的表示方法 1. 最简式(实验式): “ 用元素...