
|
学习小专题 |

|
学习小专题 |
 [物质结构与性质综合] 物质结构与性质简答题汇总 作者:化学自习室 来源:未知 日期:2025-08-08 14:56:08 点击:99 所属专题:物质结构说理题
[物质结构与性质综合] 物质结构与性质简答题汇总 作者:化学自习室 来源:未知 日期:2025-08-08 14:56:08 点击:99 所属专题:物质结构说理题
...
 [物质结构与性质综合] 物质结构类答题规范 作者:化学自习室 来源:未知 日期:2025-05-21 19:50:33 点击:140 所属专题:物质结构说理题
[物质结构与性质综合] 物质结构类答题规范 作者:化学自习室 来源:未知 日期:2025-05-21 19:50:33 点击:140 所属专题:物质结构说理题
1.有关电离能的考点的答题模板 ①氮元素的第一电离能比同周期相邻元素大的原因是:基态原子电子占据的最高能级为半充满,较稳定。 ②第一电离能F>N>O的原因:同一周期从左至右第一电离能逐增大,但N元素2p轨道为半充满稳定状态,第一电离能反常增大,因而F>N>O。 2.物质稳...
 [物质结构与性质综合] 结构教学中几个难点问题分析 作者:化学自习室 来源:未知 日期:2025-02-28 10:17:43 点击:289 所属专题:电子效应 水解反应 空间位阻
[物质结构与性质综合] 结构教学中几个难点问题分析 作者:化学自习室 来源:未知 日期:2025-02-28 10:17:43 点击:289 所属专题:电子效应 水解反应 空间位阻
...
 [物质结构与性质综合] 物质结构与性质易错点 作者:化学自习室 来源:未知 日期:2025-01-06 10:33:19 点击:370 所属专题:物质结构与性质
[物质结构与性质综合] 物质结构与性质易错点 作者:化学自习室 来源:未知 日期:2025-01-06 10:33:19 点击:370 所属专题:物质结构与性质
知识要点 1.电子运动状态的各种特征(以Mn为例,1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 2 ) (1)不同运动状态的电子数:25; (2)不同空间运动状态的电子数:15; (3)形状不同的电子云种类:3; (4)不同能级(能量)的电子种类:7; (5)最高能级的电子数:5; (6)最高能层的电子数:2。 2.1...
 [物质结构与性质综合] 化学工艺流程题的解题的知识总结归纳 作者:化学自习室 来源:未知 日期:2024-09-05 10:32:57 点击:458 所属专题:工艺流程知识点总结
[物质结构与性质综合] 化学工艺流程题的解题的知识总结归纳 作者:化学自习室 来源:未知 日期:2024-09-05 10:32:57 点击:458 所属专题:工艺流程知识点总结
一. 解题要领 解题步骤 解题策略 首尾呼应 找出主线 1. 对照原料和产品,确定核心反应和核心辅料 2. 依核心反应,明确流程主线、支线和除杂任务 分段剖析 明析细节 3. 以核心辅助原料为准,把流程划分为原料预处理、核心反应和产品分离提纯三个阶段 4. 依箭头指向,分析...
 [物质结构与性质综合] 常考物质结构归纳 作者:化学自习室 来源:未知 日期:2024-09-05 10:29:46 点击:497 所属专题:物质结构与性质
[物质结构与性质综合] 常考物质结构归纳 作者:化学自习室 来源:未知 日期:2024-09-05 10:29:46 点击:497 所属专题:物质结构与性质
一、物质结构常见的表示方法 1. 最简式(实验式): “ 用元素符号表示化合物中各元素的原子 ( 或离子 ) 比 , 这种式子叫做最简式 ( 又叫实验式 ) 。 2. 分子式: 用元素符号表示单质或化合物分子组成的式子 。 3. 电子式: 化学中常在元素符号周围用小黑点 “·” 或小...
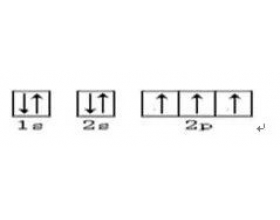 [物质结构与性质综合] 高考物质结构复习疑难点汇总 作者:化学自习室 来源:未知 日期:2024-03-20 08:36:55 点击:421 所属专题:物质结构与性质
[物质结构与性质综合] 高考物质结构复习疑难点汇总 作者:化学自习室 来源:未知 日期:2024-03-20 08:36:55 点击:421 所属专题:物质结构与性质
一、电子的运动状态与电子的空间运动状态不同 电子的运动状态包括空间运动状态和自旋。例如:C原子核外电子的运动状态有6种,核外电子的空间运动状态有4种。电子的运动状态就是电子数。电子的空间运动状态就是轨道数。 1.电子云。 它是电子在原子核外单位体积内出现概...
 [物质结构与性质综合] 常考的物质结构 作者:化学自习室 来源:未知 日期:2023-08-12 09:56:20 点击:1816 所属专题:晶体结构 电子式
[物质结构与性质综合] 常考的物质结构 作者:化学自习室 来源:未知 日期:2023-08-12 09:56:20 点击:1816 所属专题:晶体结构 电子式
一、物质结构常见的表示方法 1. 最简式(实验式): “ 用元素符号表示化合物中各元素的原子 ( 或离子 ) 比 , 这种式子叫做最简式 ( 又叫实验式 ) 。 2. 分子式: 用元素符号表示单质或化合物分子组成的式子。 3. 电子式: 化学中常在元素符号周围用小黑点 “·” 或小...
 [物质结构与性质综合] 物质结构与性质超级判断题集锦 作者:化学自习室 来源:未知 日期:2023-05-19 15:59:21 点击:3921 所属专题:物质结构与性质
[物质结构与性质综合] 物质结构与性质超级判断题集锦 作者:化学自习室 来源:未知 日期:2023-05-19 15:59:21 点击:3921 所属专题:物质结构与性质
01.原子结构 02.核素原子一定含有质子和中子 【错误;反例如氕原子,只含有一个质子,没有中子。】 03.任何粒子的质子数等于电子数 【错误;原子的质子数等于电子数。】 04.中子数不同而质子数相同的粒子一定是同种元素的不同核素 【错误;如 35 17 Cl与 35 17 Cl - 。...
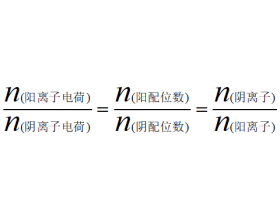 [物质结构与性质综合] 常见晶体结构计算类型总结 作者:化学自习室 来源:未知 日期:2021-12-20 09:40:16 点击:3207 所属专题:晶体结构计算
[物质结构与性质综合] 常见晶体结构计算类型总结 作者:化学自习室 来源:未知 日期:2021-12-20 09:40:16 点击:3207 所属专题:晶体结构计算
注意:阴阳离子的配位数与化学式的关系 例如,CaF 2 晶胞中 晶体 类型(晶胞原型) 晶胞 晶胞配位数或两个相同原子(离子)之间的最短距离 晶胞粒子数公式中X值 晶胞密度或体积(含ρ\a\M\NA式子) 两原子的最短距离d /边长a与半径r关系 晶胞图 金属晶体 简单立方型(棱长=2...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。...
1.有关电离能的考点的答题模板 ①氮元素的第一电离能比同周期相邻元素大的原因是:基态...
...
知识要点 1.电子运动状态的各种特征(以Mn为例,1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 2 )...
一. 解题要领 解题步骤 解题策略 首尾呼应 找出主线 1. 对照原料和产品,确定核心反应...
一、物质结构常见的表示方法 1. 最简式(实验式): “ 用元素符号表示化合物中各元素...
一、电子的运动状态与电子的空间运动状态不同 电子的运动状态包括空间运动状态和自旋...
01.原子结构 02.核素原子一定含有质子和中子 【错误;反例如氕原子,只含有一个质子,...