
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
注意:阴阳离子的配位数与化学式的关系
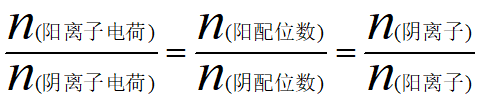
例如,CaF2晶胞中

晶体 | 类型(晶胞原型) | 晶胞 | 晶胞配位数或两个相同原子(离子)之间的最短距离 | 晶胞粒子数公式中X值 | 晶胞密度或体积(含ρ\a\M\NA式子)
| 两原子的最短距离d /边长a与半径r关系
| 晶胞图 |
金属晶体 | 简单立方型(棱长=2个原子半径) | Po | Po←(Po):6
| Po=1 x=1 |
| d=边长a=2r(Po) |
|
CuN3 | Cu←(N): 6 N←(Cu): 2 Cu←(Cu): 6 | Cu=1 N=3 x=1 |
| 2d=边长a =2[r(Cu)+r(N)]
|
| ||
体心立方型 | Na\K \Fe\w | Na←(Na): 8 K←(K): 8 Fe←(Fe): 8 w←(w): 8 | Na=2 x=2 |
| d=1/2(体对角线)=2r(Na) |
| |
面心立方型 (面对角线的1/2=4个原子半径) | Cu\Ag\Au | Cu←(Cu): 12 Ag←(Ag): 12 Au←(Au): 12 | Cu=4 x=4 |
| d=1/2(面对角线)=2r(Cu) |
| |
Kr
|
Kr←(Kr):12
| Kr=4 x=4 |
| d=1/2面对角线=2r(Kr) |
| ||
CO2 |
CO2←(CO2):12
| CO2=4 x=4 |
| d=1/2(面对角线)=2r(CO2) |
| ||
Cu3Ni
| Cu←(Ni): 4 Ni←(Cu): 12 Ni←(Ni): 6 | Cu=3 Ni=1 x=1 |
| d=1/2(面对角线)=r(Cu)+r(Ni) |
| ||
混合型 (有顶点、面心、体心) | KIO3 | I←(K): 8 K←(O): 12 O←(K): 4 | I=1;K=1 O=3 x=1 |
|
| ||
CaTiO3 | O2-←(Ti4+):4 Ti4+←(O2-):12 Ti4+←(Ca2+):8 | Ti4+=1 O2-=3 Ca2+=1 x=1 |
|
| |||
六方最密型 | Mg\Ti\Zn | Mg←(Mg): 12 Ti←(Ti): 12 Zn←(Zn): 12 | Mg=6 x=6 |
| d=边长=r(Mg)+r(Mg) |
| |
MnBi
| Mn←(Bi): 6 Bi←(Mn): 6 | Mn=6 Bi=6 x=6 | 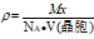 |  | |||
石墨C
| C←(C): 3 | C=4 x=4 | 棱柱的底面为菱形,由两个等边三角形构成,每个等边三角形的中心到顶点距离最近且为2r(C) | d=r(C)+r(C)≠边长=体内C到周围等长的三个C的距离 | 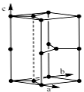 | ||
离子晶体 | NaCl型 (两个不同原子间的最短距离为棱长的1/2) | NaCl | Na+←(Cl-): 6 Cl-←(Na+): 6 Na+←(Na+): 12 Cl-←(Cl-): 12 | 2d=边长=2[r(Na+)+r(Cl-)] |
| ||
CuO | Cu2+←(O2-): 6 O2-←(Cu2+): 6 Cu2+←(Cu2+): 12 O2-←(O2-): 12 | 2d=边长=2[r(Cu2+)+r(O2-)] |
| ||||
MgO | Mg2+←(O2-): 6 O2-←Mg2+): 6 Mg2+←(Mg2+): 12 O2-←(O2-): 12 | 2d=边长=2[r(Mg2+)+r(O2-)] |
| ||||
CaO2 | Ca2+←(O22-): 6 O22-←(Ca2+): 6 Ca2+←(Ca2+): 12 O22-←(O22-): 12 |
| |||||
CsCl型 (同简单立方型) (两个不同原子间的最短距离为体对角线的1/2) | CsCl | Cs+←(Cl-): 8 Cl-←(Cs+): 8 Cs+←(Cs+): 6 Cl-←(Cl-): 6 | d=1/2体对角线=r(Cs+)+r(Cl-) |
| |||
NH4Cl | NH4+←(Cl-): 8 Cl-←(NH4+): 8 NH4+←(NH4+): 6 Cl-←(Cl-): 6 | 2d=体对角线=2[r(NH4+)+r(Cl-)] |
| ||||
NaNO2 | Na+←(NO2-): 8 NO2-←(Na+): 8 Na+←(Na+): 6 NO2-←(NO2-): 8 |
| |||||
CaF2型 (两个不同原子间的最短距离为体对角线的1/4)) | CaF2 (MgF2) | Ca2+←(F-): 4 F-←(Ca2+): 8 Ca2+←(Ca2+): 6 F-←(F-): 12 | d=1/4体对角线=r(Ca2+)+r(F-)] |
| |||
Na2O | Na+←(O2-): 4 O2-←(Na+): 8 Na+←(Na+): 6 O2-←(O2-): 12 | d=1/4体对角线=r(Na+)+r(O2-)] |
| ||||
原子晶体 | 金刚石型 (两个不同间的最短距离为体对角线1/4)) | 金刚石C、Si、B | C←(C): 4 Si←(Si): 4 B←(B): 4
|
|
| ||
CuO | Cu←(O): 4 O←(Cu): 4
| d=1/4体对角线=r(Cu)+r(O)] |
| ||||
CuCl | Cu←(Cl): 4 Cl←(Cu): 4
| d=1/4体对角线=r(Cu)+r(Cl)]
|
| ||||
ZnS (CuF) | Zn←(S): 4 S←(Zn): 4
| d=1/4体对角线=r(Zn)+r(S)] |
| ||||
Cu2O (Cu2Se) | Cu←(O): 2 O←(Cu): 4
| d=1/4体对角线=r(Cu)+r(O)] |
| ||||
磷化硼(BP)
| B←(P): 4 P←(B): 4
| d=1/4体对角线=r(B)+r(P)] |
| ||||
CuS (GaN)
| Cu←(S): 4 S←(Cu): 4
| d=1/4体对角线=r(Cu)+r(S)] |
| ||||
GaAs
| Ga←(As): 4 As←(Ga): 4
| d=1/4体对角线=r(Ga)+r(As)] |
| ||||
硒化锌ZnSe | Zn←(Se): 4 Se←(Zn): 4
| d=1/4体对角线=r(Zn)+r(Se)] |
| ||||
SiO2型 (Si-Si间距为体对角线1/4) | SiO2 | Si←(O): 4 O←(Si): 2
|
|

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
...
1.有关电离能的考点的答题模板 ①氮元素的第一电离能比同周期...
...
知识要点 1.电子运动状态的各种特征(以Mn为例,1s 2 2s 2 2p 6 3s ...
一. 解题要领 解题步骤 解题策略 首尾呼应 找出主线 1. 对照原料...
一、物质结构常见的表示方法 1. 最简式(实验式): “ 用元素...