
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、电子的运动状态与电子的空间运动状态不同
电子的运动状态包括空间运动状态和自旋。
例如:C原子核外电子的运动状态有6种,核外电子的空间运动状态有4种。
电子的运动状态就是电子数。
电子的空间运动状态就是轨道数。
1.电子云。
它是电子在原子核外单位体积内出现概率的大小,是核外电子运动状态的形象化描述。电子云图中小黑点的疏密表示电子在原子核外单位体积内出现的概率大小。
2.电子层又称能层。
它是描述原子核外电子离核的远近, n决定原子的电子层数。n=1、2、3、4、5、6、7等电子层分别为K、L、M、N、O、P、Q等符号表示。能层与电子能量有关,决定着电子能量的高低。
3.原子轨道。
它是描述原子中单个电子的空间运动状态,每个原子轨道由电子层、能级、电子的运动空间形状和伸展方向共同描述。原子轨道分别为s、p、d、f轨道。
4.能级又称电子亚层。
它是描述原子轨道的形状,如s、p等轨道具有不同形状电子云分别呈球形、纺锤形(或哑铃形)等。相同亚层中的原子轨道(电子运动空间的形状相同)有不同的空间伸展方向,决定该种原子轨道的个数,如s-1,p-3,d-5,f-7。能级与电子能量有关,同一能层中不同形状的轨道具有不同的能量。但同一能层中的不同伸展方向的能级具有相同的能量。
5.电子自旋。
它是描述处于同一轨道的电子只分为顺时针和逆时针两种,它只代表电子的两种不同状态。
6.原子核外电子的运动状态。
它是由该电子所处的电子层、原子轨道的形状、原子轨道的伸展方向、电子自旋等四个方面决定。原子核外电子的运动状态数即为原子序数。如原子序数为19的钾原子核外电子有19种不同运动状态。
7.外围电子、外层电子、价电子、价层电子等。
外围电子与外层电子定义相同,是指最后排入一个能级组上的电子,或称为原子核外最高能级组上的电子。外围电子与价电子概念不同,外围电子包括成键电子和非成键电子。
价电子与价层电子定义类似,价电子又称为特征电子,是指决定化学性质的电子,或认为能决定元素化合价的电子,或认为化学反应中可以失去的电子,或认为原子核外电子中能与其他原子相互作用形成化学键的电子。
对于主族元素来说:价电子等于最外层电子等于外围电子,它们是一个概念。如S原子的价电子排布为3s23p4 。
对于副族元素来说:在高中范围内,价电子等于最外层电子(4s电子)与次外层的部分电子(3d电子)之和,即等于外围电子。如Fe原子的价电子排布为3d64s2。价电子所处的能级称为价电子层。
在一种化合物中,价层电子数除了中心原子的价电子外,还包括与中心原子键合的周围原子的电子。如CO2中C原子的价电子为4,价层电子数为8。
8.s、p、d、f 电子、单电子、未成对电子、成对电子、共用电子、成键电子、孤对电子等。
在s、p、d、f 轨道上的电子称为s、p、d、f 电子。单电子与未成对电子的意思是一样的,单电子是指不成对的电子,即单独占据一个轨道的单电子。如N原子中有3个未成对电子。成对电子即一个轨道占据2个电子。如N原子中有2对成对电子。成对电子包含成键电子、共用电子、孤对电子等。共用电子就是成键电子,指的是位于两个原子之间共有的电子。
孤对电子是没有成键的自旋方向相反的两个电子。如水分子中含有2对成键电子与2对孤对电子。与这些概念相对应的就有成对电子对数、价层电子对数、共用电子对数、孤电子对数、自旋相反的电子对数等说法。
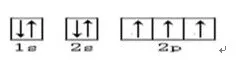
9.轨道表示式或轨道表示图或电子排布图等。
轨道表示式或轨道表示图或电子排布图是同一种式子。它能直观反映各轨道的能量的高低及各轨道上的电子分布情况与自旋方向。如N原子的轨道表示式:
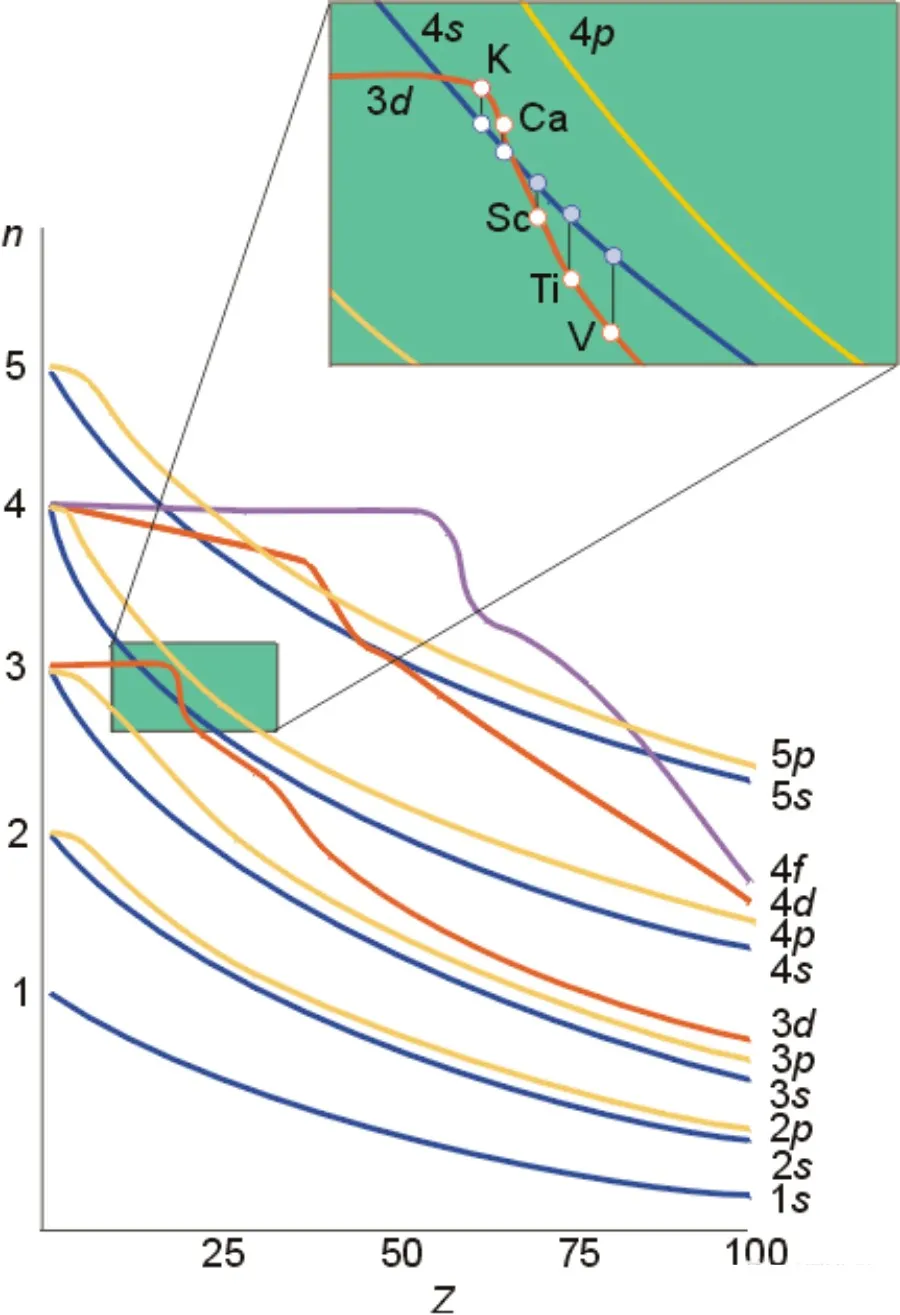
二、4s还是3d能量高
在3d、4s都没有电子的时候,能量是3d高于4s,当形成原子以后,填充了电子,力场发生变化,不再能级交错,就是4s高于3d。
三、半径问题
1、原子半径:Li大于Cl。
第二周期元素Li大于第三周期元素Al、Si、P、S、Cl;
第二周期元素Be大于第三周期元素P、S、Cl。
2、离子半径:许多离子半径大于阳离子半径。
F-离子半径(1.33)要大于Ca2+离子(1.06)。
H-离子的半径(1.54)比Ca2+也大。
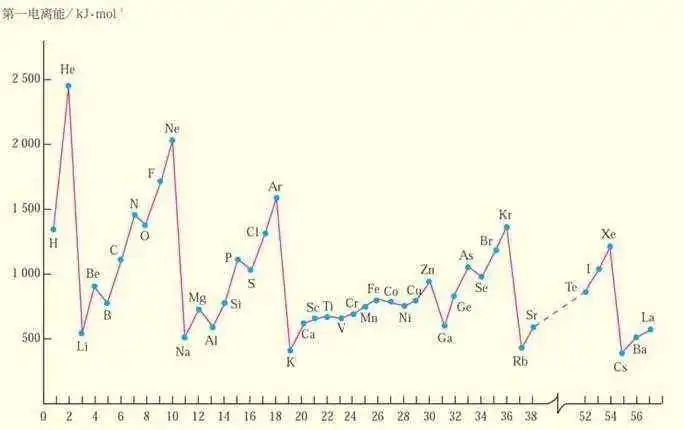
1、只有电离能比较包括稀有气体。
通常情况下,当原子核外电子排布的能量相等的轨道上形成全空(p0、d0、f0)、半满(p3、d5、f7)和全满(p6、d10、f14)结构时,原子的能量较低,该元素具有较大的第一电离能。注意一般没有s轨道。
2、电负性注意H为2.1
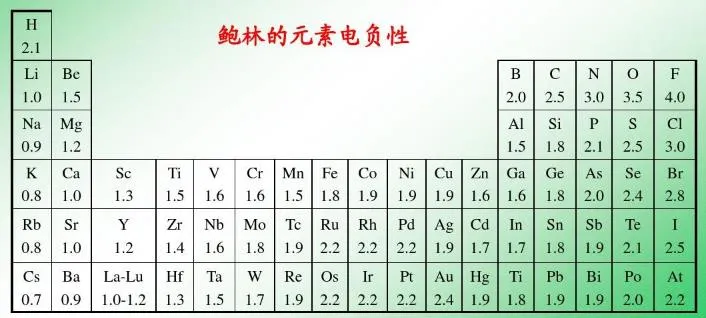
3、NCl3中的化合价
(1)元素周期律是同周期、同主族元素金属性、非金属性的规律性总结,也是比较元素金属性、非金属性强弱的定性标准。因此,不同周期、也不同主族的N、Cl无法用周期律直接比较。
(2)有很多化学现象表明n(的电负性稍大于)Cl,即N的非金属性稍强于Cl。
例如:①氢氮键的偶极矩大于氢氯键;②氨分子间有较强的氢键, 而HCl分子间只有很弱的氢键(通常忽略不计) ;③NCl3的水解产物是NH3和HClO, 说明在NCl3分子中, N为带部分负电荷端、Cl为带部分正电荷端。
但也有一些化学现象有相反的表明:如Cl2与NH3发生置换反应生成HCl和N2,所呈现出的氧化还原反应规律是Cl2的氧化性强于N2。这可能与Cl2、N2的分子结构有关。
(3)N和Cl的3种变化规律一致,电负性值都指向的是N的非金属性稍强于Cl。
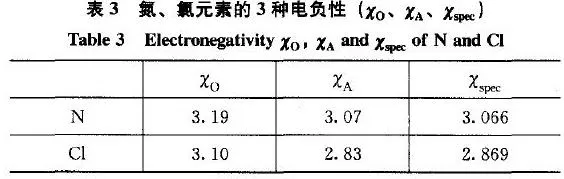
所以,对于像N、Cl这样非金属性相近的元素,应根据其化合物中的价态、原子轨道成键等要素综合考查它的动态电负性,比较其在某特定化合物中所呈现出的非金属性的相对强弱。故在NCl3分子中,所呈现的动态电负性之一氮的电负性(3.19)大于氯的电负性(3.10),因此,NCl3中化合价一般是认为N为-3,Cl为+1价。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
...
1.有关电离能的考点的答题模板 ①氮元素的第一电离能比同周期...
...
知识要点 1.电子运动状态的各种特征(以Mn为例,1s 2 2s 2 2p 6 3s ...
一. 解题要领 解题步骤 解题策略 首尾呼应 找出主线 1. 对照原料...
一、物质结构常见的表示方法 1. 最简式(实验式): “ 用元素...