
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
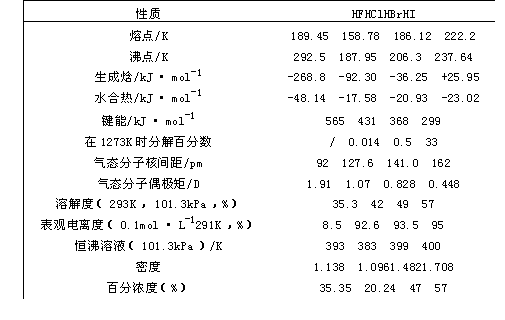
卤化氢皆为无色、有刺激嗅味的气体,暴露在空气中会“冒烟”,这是因为卤化氢与空气中的水蒸气结合成酸雾的缘故。表1—5列举了卤化氢的一些重要性质。
卤化氢为极性分子,HF分子的极性最大,这些分子的极性随卤族元素自上而下元素电负性的减弱,极性亦逐渐减弱。所以HI分子的极性最小。卤化氢在水中的溶解度相当之大,见表1—5,在这里可用其偶极矩数据的递减导致其溶解度递增来解释。卤化氢极易液化,液态卤化氢不导电,卤化氢的水溶液称氢卤酸,除氢氟酸外均为强酸。
1、热稳定性
![]()
衡量卤化氢热稳定性的尺度是生成焓。生成焓为负值(即放热反应)的化合物其稳定性要比生成焓为正值的化合物要高。所以卤化氢的稳定性顺序是HF>>HCl>HBr>HI。事实亦是如此,氟化氢要加热到高于1273K时分解,然而碘化氢573K时分解。这同样可以解释第Ⅵ族(16),第V(族)(15)的氢化物自上而下,随着原子序数增大,其热稳定性逐渐减弱的规律。所以溴化氢、碘化氢易分解。
表1—5卤化氢的物理性质
2、还原性
通式2HX—2e-→X2+2H+
卤素氢化物还原性的大小,决定于卤离子释放电子的能力,F-→I-释放电子能力递增,这可从卤素的电负性大小,卤离子的半径大小来进行进一步阐明。对氟来讲,电负性最大,F-离子的半径又小,由于核拉电子的能力强,释放电子能力必弱。其还原性就差,碘则相反。由于HBr、HI在空气中极易被氧化,所以氢溴酸、氢碘酸试剂用棕色瓶来贮存。它们的还原性顺序是:
HF<<HCl<HBr<HI
事实又是怎样呢?当萤石(CaF2)或氯化钠与浓硫酸反应,利用高沸点酸置换低沸点酸制卤化氢。
CaF2+H2SO4—→CaSO4+2HF
NaCl+H2SO4—→NaHSO4+HCl
当溴化钠或碘化钠与浓硫酸反应,发生下列反应:
2NaBr+3H2SO4—→2NaHSO4+Br2+SO2↑+2H2O
8NaI+9H2SO4—→8NaHSO4+4I2+H2S↑+4H2O
以上事实告诉我们不能用浓硫酸与NaBr或NaI反应来制得相应的HBr或HI。工业上经常用浓磷酸来代替浓硫酸制备HBr或HI,这是因为浓磷酸没有氧化性。但它又是高沸点酸。F-离子最难释放电子,所以欲制取氟必须借助于电解。实验室制备氯是利用氟离子的还原性,一般可用MnO2、KMnO4、PbO2等氧化剂,氧化浓盐酸制氯。
MnO2+4HCl(浓)![]() MnCl2+Cl2+2H2O
MnCl2+Cl2+2H2O
2KMnO4+16HCl(浓)![]() +2MnCl2+2KCl+5Cl2+8H2O
+2MnCl2+2KCl+5Cl2+8H2O
3、酸性
![]()

其酸性强度对氢氟酸来讲是弱酸,由盐酸至氢碘酸依次酸性增强,氢碘酸是极强的酸。怎么解释呢。若用表1—3中的偶极矩数据是不能得到满意的解释,因此用键能的大小来进行解释。
氢卤酸的酸性强度变化规律可以用
![]()
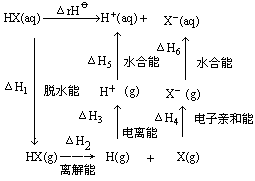
ΔRH![]() 表示氢卤酸电离反应的热效应,应当等于上述循环中各步能量项的总和:
表示氢卤酸电离反应的热效应,应当等于上述循环中各步能量项的总和:
ΔRH![]() =ΔH1+ΔH2+ΔH3+ΔH4+ΔH5+ΔH6
=ΔH1+ΔH2+ΔH3+ΔH4+ΔH5+ΔH6
该反应的趋势大小由ΔRG![]() 决定,ΔRG
决定,ΔRG![]() =ΔRH
=ΔRH![]() -TΔRS
-TΔRS![]()
现将上述循环中各步的ΔRH![]() 、TΔRS
、TΔRS![]() 、ΔRG
、ΔRG![]() 列于表1—6中。
列于表1—6中。
表1—6氢卤酸电离反应能量循环过程
中的焓变和熵变 (单位:KJ·mol-1)
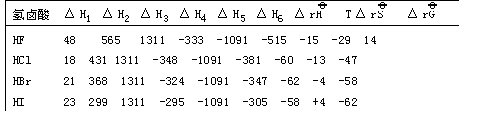
由上表可以看出六步中,最关键的是第二步解离能即键断裂能。HF的键断裂能特别高几乎是HI键断裂能的两倍。另外,氢氟酸在水中存在氢键,所以其脱水能比其它氢卤酸高,电子亲合能具有较低的数值,虽然氟离子的水合能最高,但也不足以补偿这些差值。所以ΔRH![]() 这一项对HF的电离反应放出的热量最少。
这一项对HF的电离反应放出的热量最少。
根据表1—6的数据,按热力学的计算公式,还能计算Ka值。
ΔRG![]() =-RTlNK(298K)
=-RTlNK(298K)
![]()
![]()
此公式必须在298K使用,ΔRG![]() 的单位要用KJ·mol-1。
的单位要用KJ·mol-1。
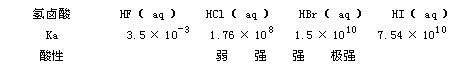
4、恒沸溶液
氢卤酸具有挥发性,如何来制得纯的浓盐酸呢?将工业盐酸蒸馏,最终是否能得到浓盐酸呢?在这里要介绍一下恒沸现象。
常压下蒸馏盐酸时,不管蒸馏的是稀溶液还是浓溶液,溶液的沸点和组成会不断改变,但最后都会达到溶液组成和沸点恒定不变的状态,此时的溶液叫做恒沸溶液。恒沸溶液并不是氢卤酸和水的固定比合物,因为恒沸溶液的组分随压力而改变。下面以盐酸为例:
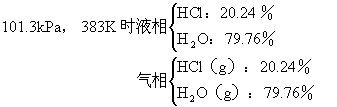

利用恒沸现象蒸馏粗盐酸可以得到合格的试剂。所得之恒沸溶液浓度为20.24%,再吸收纯净的氯化氢气,最终得到试剂盐酸,氯化氢的含量为37%。比重为1.18,约12mol·L-1。
下面将常见几种试剂的恒沸组成与恒沸点列于表1—7。
表1—7几种常用试剂的恒沸组成与恒沸点(101KPa)
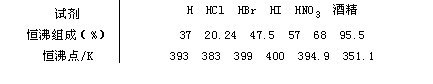
由上表可见,恒沸现象不仅存在于氢卤酸,也可以适用于硝酸等无机含氧酸及有机试剂,如酒精等。氢卤酸均可在常压或负压的条件下,通过蒸馏来纯化试剂。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。次氯酸的酸性不强,却有很强的氧化性、漂白性,次氯酸的氧化性凭什么比高氯酸的强? ...
一、HNO 3 为什么不能氧化Cl - ? 硝酸HNO 3 是强氧化剂,Cl - 氯离子是还原剂,但...
氢氟酸是一弱酸(298K时,Ka=3.5×10 -4 )。与其它弱酸相同,浓度越稀,HF电离度越大...
卤素是很活泼的非金属元素。单质最典型的化学性质是强氧化性,卤素单质氧化性递变规律...
F Cl Br I ,卤素,第 Ⅶ A 族, 价电子构型 ns 2 np 5 虽然是同一族,价电子构型相同...
一、 卤素互化物 不同卤素原子之间相互形成的化合物称为卤素互化物。这类化合物可用通...