
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
化学的是主要研究内容之一,便是探讨物质的组成与性质间关系。物质熔点和其化学组成间的关系,一直也是它试图解释的一个问题。
近代化学理论对物质熔点的高低已有相当可信、并比较完美的解释。但由于化学物质的种类繁多,在比较不同物质熔点时有可能会涉及诸多理论,需要有较强的分析问题能力,所以物质熔点比较一直还是化学教学中的一个难点。
本文主要针对化学物质熔点比较的问题,讨论如何灵活运用一般的结构理论来分析化学问题,以期使大家对所学过的化学结构理论有更深刻地理解。
一、
固态化学物质都是由一些诸如分子、离子或原子之类的微粒组成的。这些微粒间结合力属性与大小的不同,是造成物质熔点有差别的主要原因。
所以晶体类型的划分,是比较物质熔点时要首先考虑的问题。一般情况下有:原子晶体的熔点大于离子晶体,离子晶体的熔点又大于分子晶体,这样的简单变化规律。
如SiO2和CO2熔点的不同,可以很简单地由SiO2属于原子晶体,而CO2属于分子晶体来加以判别。SiO2的熔点要远高于CO2的熔点。
在原子晶体、离子晶体、分子晶体这三类晶体分别与金属晶体进行熔点比较时,可能会有一定的困难。这是因为金属晶体微粒间结合力的强度可以在很大的范围内变化,不同金属的熔点相差悬殊。如金属W的熔点高达3000℃以上,而金属汞常温下为液态。
但是把典型的高熔点金属(如W)与典型的离子晶体、或分子晶体的熔点的比较;或是把典型的低熔点金属(如Hg)与原子晶体、或离子晶体的熔点的比较;在教学中还是存在的。这是为了通过练习,使学生加深对这些有特殊高(或低)熔点金属的印象。
总之,最好不要随意进行金属晶体与其它几类晶体间,物质熔点的比较。这种比较,即使是给出了熔点的具体数值,只是让学生来解释,也无更多的理论意义。其收效充其量也仅是使学生多了解了一些个别的性质而已。
二、金属晶体熔的点比较
金属晶体的熔点是金属内聚力的反映,是物质内部质点间的作用力大小的度量,是金属键强度的标志。
对同主族金属元素来说,熔点主要取决于金属原子的半径大小和价电子的数目。如第Ⅰa族碱金属元素的Li、Na、K、Rb(价电子数都是1),随原子半径的递增,质点间的作用力减弱,有熔点会逐渐降低的规律。碱土金属的熔点也有随原子序数增加,熔点降低的总趋势。但变化有些许的“不规则”,这是由于碱土金属的金属晶格类型不是完全相同而造成的。金属Be、Mg为六方晶格,Ca、Sr为面心立方晶格,Ba为体心立方晶格。
对同周期的主族元素来说,有从左到右,随价电子数依次增加、原子半径同时减小,金属键强度增大,熔点逐渐升高的规律。如第三周期的Na、Mg、Al就符合熔点逐渐升高的规律。
过渡元素金属的熔点则由原子的未成对电子数来决定。由于ⅥB族的Cr、MO、W有(N-1)D5、ns1的价电子构型,因而它们在其所处的各过渡系中都有最多的未成对电子数,所以有较高、或最高的熔点。
ⅡB族(锌族)的Zn、Cd、Hg的熔点不但远低于AⅡ族(碱土金属)相应金属的熔点,而且还低于IB族(铜族)相应金属的熔点。一般认为这是由于该族元素原子的最外层电子,成对后的特殊的稳定性造成的。在汞原子里,其6s2电子最稳定(即通常所说的惰性电子对效应),不易参与金属键的形成,所以金属键最弱,在室温时仍为液体。Zn、Cd的S2电子对也有一定的稳定性,所以也有较低的熔点。
合金通常都具有,熔点要低于纯组分金属熔点的性质。如Na和K的熔点分别为370.8K和336.6K。但它们的一种合金(Na占22.8%、K占77.2%)的熔点仅为260.7K。
三、典型离子晶体熔点的比较
对典型的离子晶体来说,离子晶体中阴阳离子间的作用力只是静电力,熔点的高低只与离子间的静电作用力的强弱有关。离子间静电力的强弱可以用晶格能、或简化为物理学中的点电荷的作用力公式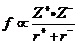 (z为离子所带电荷、R为离子的半径),来加以讨论。
(z为离子所带电荷、R为离子的半径),来加以讨论。
由该式可以看出,当离子所带电荷不同时,可以直接用离子电荷多少来判断离子间作用力大小、即判断离子晶体熔点高低。这是因为在与静电力成正比的右端分数项中,分子的数值间可以有倍数的差别,要远远大于分母的变化幅度。也就是说,子通常的情况下,如果两离子化合物的离子所带电荷不同,就可以直接根据电荷的多少,来判断熔点的高低。只有在电荷相同时,才有必要去比较离子半径大小的影响。由此可以导出如下的规律:
在同一周期的主族元素的离子化合物中,随着阳离子的电荷数的增加,其熔点也要增加。如NaF与MgF2的熔点分别为992和1399℃。可以认为,主要是由于后者MgF2的阳离子Mg2+带有2个单位的正电荷,比Na+的电荷数要大1倍,而造成的。
在同一主族的元素中,有随着阳离子的半径变大,晶格能降低,相应的离子化合物的熔点也要变小的趋势。如NaF、KF、RbF随阳离子的半径增大而熔点降低。
在同一主族的元素中,还有随阴离子的半径变大,相应的离子化合物的熔点也要变小的趋势。如KF、KCl、KBr随阴离子的半径增大而熔点降低。
需要特别注意的是,对非典型的离子晶体(即有不可忽略的共价性成分的离子化合物),则必须要考虑离子极化等因素的影响。
四、典型分子晶体的熔点
在分子晶体中,把分子约束起来的通常是范德华力(或称为分子间作用力)。而在构成分子间作用力的取向力、诱导力、色散力这三者中,色散力一般又是最主要的、起决定性作用的因素。并且对同类物质来说,色散力的大小,只取决于分子量。这就使我们可以方便地用分子量来比较几类物质的熔点。
对同一主族元素的相应物质,随着原子序数的增加,分子量的增加,分子间作用力的增加,有物质熔点逐步增加的变化趋势。如单质F2、Cl2、Br2、I2熔点的依次升高;氢化物HCl、HBr、HI熔点的依次升高;卤化物CF4、CCl4、CBr4熔点的依次升高,都是很典型的例子。
需要特别注意的是,氢键是分子间较强的作用力,它可以使物质的熔点有很大程度的增加。在讨论HF、含有OH、NH这些基团的化合物熔点时,一定要特别考虑到氢键生成的影响。如H2O的熔点远高于H2S的熔点(可以完全抵消掉色散力的影响),就完全是氢键的作用的结果。HF的熔点高于HCl,NH3的熔点高于P H3,也是因为前者属于第二周期后几个元素的氢化物,在它们的分子间能生成氢键。
像第二周期的能生成氢键的三种氢化物,有熔点H2O>NH3>HF的序列(分别为0、-78、-83℃)。可用每个分子平均生成的氢键数目不同而加以解释,一个水分子平均有两个氢键,而每个NH3或HF分子平均都只有一个氢键。NH3与HF的熔点区别,也正好与据分子量判断的结果相吻合。
五、离子极化对化合物熔点的影响
离子极化理论的主要观点是:从物质是由离子组成、这一模型的角度来看问题;阴阳离子相互间有作用,主要表现为阳离子吸引阴离子的电子云(有极化能力),及阴离子的电子云发生形变(用变形性来描述);阳离子的极化能力及阴离子的变形性都与离子所带的电荷及半径有关;极化的结果之一便是使原有的离子键向共价键过渡。
但这一键型的过渡,可能造成两种完全不同的晶体类型改变结果。因为原子可以靠共价键结合成原子晶体;原子也可以靠共价键结合成小分子,小分子再靠分子间作用力结合成分子晶体。我们知道原子晶体的熔点一般要高于分子晶体,而分子晶体的熔点一般要低于离子晶体,所以讨论时必须要把握住这两种截然不同的过渡方向。
当卤族元素的离子X-为阴离子时,即使在很强的极化作用下,卤原子(只有一个成单电子)也只能以单键的形式与电负性小的原子结合成小分子的MX、MX2、MX3。如对应1、2、3价的同周期的阳离子Na+、Mg2+、Al3+,也只是生成NaCl、MgCl2、AlCl3这些小分子或。离子晶体只能向分子晶体过渡,熔点逐渐降低。
其中的NaCl基本还是离子晶体。而MgCl2已有相当部分的分子晶体成分,熔点要比纯离子晶体低些。像以与双聚分析形式存在的AlCl3,已经可以算得上是标准的分子晶体,当然熔点会最低。。
对同周期的某元素化合物进行熔点比较时,一定要会综合地看问题。如对NaCl、MgCl2、AlCl3、SiCl4、PCl5这一系列,就有熔点逐渐降级、然后再升高的变化(对应的熔点为801、712、193、-68、146)。前四个的熔点降低,反映的是由于极化作用增强,导致晶体类型由离子晶体向分子晶体转变。后两个间的熔点升高,是因为对典型的分子晶体来说,应根据分子量大小来比较熔点的高低(后者的分子量大)。
对氧族元素的阴离子,在阳离子的极化作用下,其有2个成单电子的原子能以不止一个单键的形式与电负性小的原子结合成具有空间的网状结构的原子晶体,使离子晶体向原子晶体过渡。如Na2O、MgO、Al2O3、SiO2序列,就是典型的离子晶体向原子晶体过渡的例子,这一过渡,有熔点的逐渐升高的趋势。
对同一主族元素的相应的化合物来说,有比较阳离子的极化能力和比较阴离子的变形性这样的两个序列:
阳离子不同、阴离子相同时,随阳离子离子半径的增加,阳离子的极化能力减弱。极化作用由强到弱。如BeCl2、MgCl2、CaCl2这一系列,有熔点由低到高的变化(这一变化趋势,是用晶格能无法解释的)。
阳离子相同、阴离子不同时,随离子半径的增加,阴离子的变形性增大,极化增强,熔点逐渐降低。如AlF3、AlCl3这一系列的熔点的变化(这一变化趋势虽然与晶格能的逐渐减小的趋势相同,但这种熔点的大幅度降低最好还是用离子极化来加以解释)。
六、.其他一些影响物质熔点的因素
外界条件对物质的熔点也有明显的影响。
由水的相图可以知道,增大压强会使冰的熔点降低。由稀溶液的蒸气压下降可以知道,冰在海水中的熔点也会降低。后者是实验室中用冰盐浴来制冷的理论依据。
都是由S8分子构成的斜方硫与单斜硫也有不同的熔点(分别是386K及392K)。可以用其晶型不同,反映出分子的排列方式有一些差别,分子间作用力也会有差别来解释。
参考文献
[1]周宁怀译. [澳]G·H·艾尔沃德.T·J·V·芬德利编. Si化学数据手册.高等教育出版社. 1985
[2]北京师范大学等校编.无机化学(第三版).高等教育出版社. 1992

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
1、从2009年江苏高考最后一问谈起 试题在1个Cu 2 O晶胞中(如图1所...
在晶体结构中,阳离子周围的阴离子总配位数,等于阴离子周围...
配位数之比(阳离子配位数:阴离子配位数)等于化学式角码反比...
一、金刚石结构 二、二氧化硅 三、氯化钠 插入投票 投票: 高...
第二页...
...