
|
学习小专题 |

|
学习小专题 |
 [注解与辨疑d] 电负性解读 作者:程新 来源:未知 日期:2015-02-02 22:56:38 点击:4567 所属专题:电负性
[注解与辨疑d] 电负性解读 作者:程新 来源:未知 日期:2015-02-02 22:56:38 点击:4567 所属专题:电负性
定义 电负性(Electronegativity)又称为相对电负性,简称电负性。电负性综合考虑了电离能和电子亲合能,首先由莱纳斯·卡尔·鲍林于1932年引入电负性的概念,用来表示两个不同原子形成化学键时吸引电子能力的相对强弱,是元素的原子在分子中吸引共用电子的能力。通常以希腊...
 [注解与辨疑d] 电离能解读 作者:甑炳杨 来源:未知 日期:2015-02-01 17:09:34 点击:9796 所属专题:电离能
[注解与辨疑d] 电离能解读 作者:甑炳杨 来源:未知 日期:2015-02-01 17:09:34 点击:9796 所属专题:电离能
(1)定义: 气态原子或气态离子失去一个电子所需要的最小能量 。 第一电离能(I1) :处于基态的气态原子失去一个电子,生成十1 价气态阳离子所需要的能量。 第二电离能(I2) :由+1 价气态阳离子再失去一个电子形成十2 价气态限离子所需要的能量。 ( 2 )说明: ① 电离能...
 [注解与辨疑d] 关于元素电负性的讨论 作者:向小平 来源:未知 日期:2014-09-25 10:03:30 点击:2551 所属专题:电负性
[注解与辨疑d] 关于元素电负性的讨论 作者:向小平 来源:未知 日期:2014-09-25 10:03:30 点击:2551 所属专题:电负性
问题:《物质结构与性质》模块教材上的元素电负性好些数据和网络上查到的不同,为什么? 依据电负性比1.8的大或小来判断元素是金属、非金属,Sb、Bi、Pb是金属,但电负性都是1.9,大于1.8; Si、Ti电负性都是1.8,一个是金属,一个是非金属。怎么解释? P 和H 的电负性都是1...
 [注解与辨疑d] 电负性知识的应用 作者:王利平 来源:未知 日期:2014-09-14 21:12:17 点击:5776 所属专题:电负性
[注解与辨疑d] 电负性知识的应用 作者:王利平 来源:未知 日期:2014-09-14 21:12:17 点击:5776 所属专题:电负性
1.判断元素的种类 一般情况下,电负性大于1.8,为非金属元素,电负性小于1.8,为金属元素。 2.判断化学键类型 一般情况下,两元素电负性差值大于1.7时,形成离子键,两元素电负性差值小于1.7时,形成共价键。 例如: Na电负性0.9,Cl电负性3.0,二者之间的差值为2.1大于1.7...
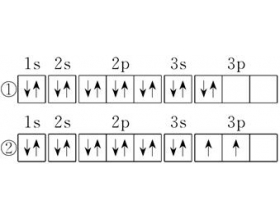 [注解与辨疑d] 关于洪特规则的解释说明 作者:刘小丹 来源:未知 日期:2014-09-14 21:09:56 点击:13122 所属专题:洪特规则 能级09 电子排布式
[注解与辨疑d] 关于洪特规则的解释说明 作者:刘小丹 来源:未知 日期:2014-09-14 21:09:56 点击:13122 所属专题:洪特规则 能级09 电子排布式
一.洪特规则的定义 当电子排布在同一能级的不同轨道时,基态原子中的电子总是优先单独占据一个轨道,而且自旋状态相同。 根据洪特规则的定义,①不符合洪特规则,①中3P能级里的2个电子应该优先单独占据一个轨道,而且自旋状态相同。②符合洪特规则的规定。 二.洪特规则的...
 [注解与辨疑d] 亚铁离子的核外电子排布式究竟是哪种? 作者:张超鹏 来源:未知 日期:2021-12-28 08:44:41 点击:17317 所属专题:铁的失电子 电子排布式
[注解与辨疑d] 亚铁离子的核外电子排布式究竟是哪种? 作者:张超鹏 来源:未知 日期:2021-12-28 08:44:41 点击:17317 所属专题:铁的失电子 电子排布式
最近在网上看到两种不同的亚铁离子核外电子排布式: 一种认为:由于铁的电子排布式为[Ar]3d 6 4s 2 ,4s为最外层,两个电子容易失去,故亚铁离子的核外电子排布式应该为[Ar]3d 6 ; 另一种认为:由于铁的电子排布式为[Ar]3d 6 4s 2 ,当失去第一个4s电子后,4s轨道还有...
 [注解与辨疑d] 为什么正2价的铜比正1价稳定? 作者:邵磊 来源:未知 日期:2021-12-28 08:35:16 点击:14280 所属专题:铜的稳定性
[注解与辨疑d] 为什么正2价的铜比正1价稳定? 作者:邵磊 来源:未知 日期:2021-12-28 08:35:16 点击:14280 所属专题:铜的稳定性
为什么铜有两个价电子?铜的电子排布式是3d 10 4s 1 ,丢掉一个电子d亚层不就正好满了? 首先明确,排电子排布式要用到三个基本原则:能量最的原理,洪特规则及洪特规则特例,不相容定律。排铜的时候主要就是,洪特规则特例的应用。 首先铜是第29号元素,所以它的前十八...
 [注解与辨疑d] 电子排布式书写注意事项 作者:张修鹏 来源:未知 日期:2014-06-25 23:06:43 点击:4831 所属专题:电子排布式
[注解与辨疑d] 电子排布式书写注意事项 作者:张修鹏 来源:未知 日期:2014-06-25 23:06:43 点击:4831 所属专题:电子排布式
根据 Pauling 原子轨道能级图和电子填充三原则, 将原子或离子的电子排布书写出来. 但在书写时, 要注意: (1)电子填充是按近似能级图自能量低向能量高的轨道排布填充的, 是为了是原子整体能量最低。但书写电子结构式时, 按方便与习惯,要把同一主层(n相同)的轨道写在一...
 [注解与辨疑1] 关于微粒的感知 作者:刘洪林 来源:未知 日期:2014-06-25 23:21:02 点击:1405 所属专题:微粒
[注解与辨疑1] 关于微粒的感知 作者:刘洪林 来源:未知 日期:2014-06-25 23:21:02 点击:1405 所属专题:微粒
物质是由微粒构成的。 如果这话仅由老师说给你,你会感觉很乏味,很没成就感。你会想,为什么这话不是先由我自己说出来呢?我已经是个中学生了,我应该有这方面的感悟的。 比如我用铅笔写字,写完一个字,我是看不出来铅笔在缩短的。写完一千字,看出来了,笔芯短了几毫...
 [注解与辨疑d] 核外电子排布的原理 作者:李小明 来源:未知 日期:2021-12-17 09:07:10 点击:9484 所属专题:核外电子排布规则
[注解与辨疑d] 核外电子排布的原理 作者:李小明 来源:未知 日期:2021-12-17 09:07:10 点击:9484 所属专题:核外电子排布规则
一、最低能量原理 所谓最低能量原理是,原子核外的电子,总是尽先占有能量最低的原子轨道,只有当能量较低的原子轨道被占满后,电子才依次进入 能量较高的轨道,以使原子处于能量最低的稳定状态。 原子轨道能量的高低为: 1.当n相同,l不同时,轨道的能量次序不s<p<d...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。【导读】第一电离能(I)和第一电子亲和能(E)从能量变化的角度描述了同一个过程的正反两...
电离能和电子亲和能都是研究元素游离态的原子的性质。电离能是衡量元素金属性大小的物...
硼,元素符号B,价电子构型2s 2 2p 1 ,第二周期第ⅢA族。 作为非金属,最高氧化数对...
多电子原子中,在考虑某个电子时,可以把其他电子对其排斥作用看作削弱了原子核对它的...
1.核外电子共有几个能层? 能层电子层,根据离原子核远近的不同,由里向外可分为第一、二...
1.一个电子的运动状态要从哪几个方面描述? 答:应从这个电子所处的能层(电子层)是第...
...
基态和激发态 什么是光谱? 光谱:不同元素的原子发生跃迁时会 吸收 ( 基态→激发态 ...