
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一.洪特规则的定义
当电子排布在同一能级的不同轨道时,基态原子中的电子总是优先单独占据一个轨道,而且自旋状态相同。
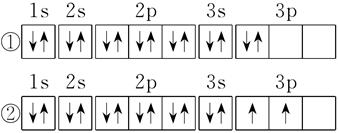
根据洪特规则的定义,①不符合洪特规则,①中3P能级里的2个电子应该优先单独占据一个轨道,而且自旋状态相同。②符合洪特规则的规定。
二.洪特规则的补充规定
洪特规则指出,等价轨道上的电子排布处于以下状态时比较稳定。
(1)全充满:p6、d10、f14
p轨道上有6个电子、d轨道上有10个电子、f轨道上有14个电子
(2)半充满:p3、d5、f7
p轨道上有3个电子、d轨道上有5个电子、f轨道上有7个电子
(3)全空:p0、d0、f0
p轨道上有0个电子、d轨道上有0个电子、f轨道上有0个电子
举例:(以铬为例)
按照能量最低原理,铬的电子排布式为1s22s22p63s23p63d44s2
但根据洪特规则的补充规定,铬的电子排布式实际为1s22s22p63s23p63d54s1,这种排布符合半充满状态,可使能量最低。
(以铜为例)
按照能量最低原理,铜的电子排布式为1s22s22p63s23p63d94s2
但根据洪特规则的补充规定,铬的电子排布式实际为1s22s22p63s23p63d104s1,这种排布符合全充满、半充满状态,可使能量最低。
三.遇到的问题
根据洪特规则中关于全充满、半充满、全空的规定,学生在写碳的电子排布式时出现了这样的情况,碳的电子排布式本来应该是1s22s22p2,结果学生按照全充满、半充满、全空的规定,将碳的电子排布式写成了1s22s12p3。我表扬了这名学生,她严格的遵循定义,学以致用,说明她进行了一定的思考。但是这里也有些更高层次的原因,导致1s22s12p3的写法是错误的。
碳的电子排布式中不遵循全充满、半充满、全空的规定的原因是:碳的2s和2p轨道之间能量相差比较大,其中一个2S电子如果放到2P上能量反而比2s22p2的电子构型能量要高,前者是激发态。对于第三周期的元素,因为3s和4s轨道之间的能量差距不是很大,所以对于Cr和Cu,按洪特规则排布能量更低。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
...
原子核外电子的真实运动状态是我们肉眼看不到的,但是可以通...
铜原子(Cu)的基态电子排布为[Ar] 3d4s,失去一个电子形成亚铜...
先让大家看看高中和大学电负性的数值图:下面的人教版高中化...
在元素周期表中,除了同周期从左到右、同主族从上到下的性质...
电负性是描述原子在化合物中吸引成键电子能力的核心物理量,...