
|
学习小专题 |

|
学习小专题 |
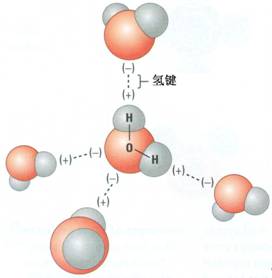 [方法与规律j] 高考化学中四大滴定的基本原理与应用 作者:化学自习室 来源:未知 日期:2020-12-15 09:35:00 点击:2455 所属专题:滴定法
[方法与规律j] 高考化学中四大滴定的基本原理与应用 作者:化学自习室 来源:未知 日期:2020-12-15 09:35:00 点击:2455 所属专题:滴定法
四大滴定即:氧化还原滴定,络合滴定,酸碱滴定,沉淀滴定。 四大滴定的区分主要是跟据反应的类型,以及是否便于测定。比如,氧化还原滴定主要用于氧化还原反应,沉淀滴定主要用于反应中产生沉淀的反应,酸碱滴定主要用于酸性物质与碱性物质的反应或者广义上的路易士酸...
 [方法与规律j] 将AgCl与AgBr的饱和溶液等体积混合,再加入足量浓AgNO3溶液,为 作者:化学自习室 来源:未知 日期:2020-11-30 16:08:01 点击:775 所属专题:溶度积计算
[方法与规律j] 将AgCl与AgBr的饱和溶液等体积混合,再加入足量浓AgNO3溶液,为 作者:化学自习室 来源:未知 日期:2020-11-30 16:08:01 点击:775 所属专题:溶度积计算
将 AgCl 与AgBr 的饱和溶液等体积混合,再 加入足量浓 AgNO 3 溶液,为什么 AgCl 和 AgBr 沉淀 都有,但以 AgCl 沉淀为主? 解析: 在 AgBr 的饱和溶液中 K sp (AgBr)= 5.53×10 -13 , c (Br - )= c (Ag + )= = 7.43×10 -7 mol·L -1 在AgCl的饱和溶液中 K sp (AgCl)...
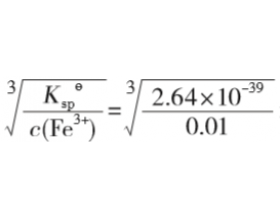 [方法与规律j] 如何求难溶氢氧化物开始沉淀和沉淀完全时的 pH ? 作者:化学自习室 来源:未知 日期:2020-11-30 15:56:08 点击:2308 所属专题:溶度积计算
[方法与规律j] 如何求难溶氢氧化物开始沉淀和沉淀完全时的 pH ? 作者:化学自习室 来源:未知 日期:2020-11-30 15:56:08 点击:2308 所属专题:溶度积计算
例9 某溶液中含杂质Fe 3+ 为 0.01 mol·L -1 ,已知 室温下Fe(OH) 3 的 K sp =2.64×10 -39 ,计算: (1)开始生成 Fe(OH) 3 沉淀的 pH; (2)Fe 3+ 沉淀完全时的 pH。(被沉 淀离子浓度小于1.0×10 -5 mol·L -1 时,可以认为已沉淀完全) 解析:开始沉淀和沉淀完全时 Fe...
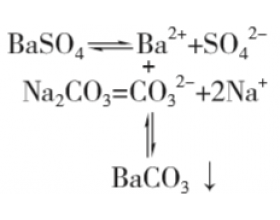 [方法与规律j] 溶解度较小的难溶电解质能否转化为溶解度 较大的难溶电解质 ? 作者:化学自习室 来源:未知 日期:2020-11-30 15:42:42 点击:1296 所属专题:溶度积计算
[方法与规律j] 溶解度较小的难溶电解质能否转化为溶解度 较大的难溶电解质 ? 作者:化学自习室 来源:未知 日期:2020-11-30 15:42:42 点击:1296 所属专题:溶度积计算
以 BaSO 4 沉淀转化为BaCO 3 沉淀为例。 K sp (BaSO 4 )=1.07×10 -10 , K sp (BaCO 3 )=2.58×10 -9 。 溶度积: K sp (BaSO 4 )< K sp (BaCO 3 ),但相差不大, 工业上能实现 BaSO 4 沉淀转化为BaCO 3 沉淀,具体做 法是把BaSO 4 置于一定量的饱和Na 2 CO 3 溶液中浸...
 [方法与规律j] 混合液中几种离子与同一种沉淀剂反应,一定是溶度积小的先沉淀吗 作者:化学自习室 来源:未知 日期:2020-11-30 15:27:50 点击:1996 所属专题:溶度积计算
[方法与规律j] 混合液中几种离子与同一种沉淀剂反应,一定是溶度积小的先沉淀吗 作者:化学自习室 来源:未知 日期:2020-11-30 15:27:50 点击:1996 所属专题:溶度积计算
例1 已知下列物质在 20 ℃下的 K sp ,见表 2。 向含有浓度均为 0.01 mol·L -1 的 Cl - 、Br - 、I - 和 Cr O 4 2 - 的溶液中,滴加 AgNO 3 溶液,生成沉淀的先后顺序如何判断? 解 析:AgCl、AgBr、AgI 均 是 AB 型,它 们 的 溶 解度可由 K sp 直接判断, K sp : K...
 [方法与规律j] 如何求难溶电解质的饱和溶液中离子的物质的量浓度? 作者:化学自习室 来源:未知 日期:2020-11-30 15:24:58 点击:1603 所属专题:溶度积计算
[方法与规律j] 如何求难溶电解质的饱和溶液中离子的物质的量浓度? 作者:化学自习室 来源:未知 日期:2020-11-30 15:24:58 点击:1603 所属专题:溶度积计算
例1 向 50 mL 0.018 mol·L -1 的 AgNO 3 溶液中加 入 50 mL 0.018 mol·L -1 的盐酸,求混合液中 c (Ag + ) 是多 少?已知 Ksp (AgCl)=1.0×10 -10 解析: 加入盐酸后溶液的总体积为100 mL, c (Ag + ) = c (Cl - )=0.009 mol · L -1 , c (Ag + )· c (Cl -...
 [方法与规律j] 在哪些情况下考虑盐的水解呢? 作者:化学自习室 来源:未知 日期:2020-07-16 16:00:03 点击:1119 所属专题:盐类水解应用
[方法与规律j] 在哪些情况下考虑盐的水解呢? 作者:化学自习室 来源:未知 日期:2020-07-16 16:00:03 点击:1119 所属专题:盐类水解应用
盐的离子跟水电离出来的氢离子或氢氧根离子生成弱电解质的反应,称为盐类的水解。 其一般规律是:谁弱谁水解,谁强显谁性;两强不水解,两弱更水解,越弱越水解。 哪么在哪些情况下考虑盐的水解呢? 1.分析判断盐溶液酸碱性时要考虑水解。 2.确定盐溶液中的离子种类和浓度时要...
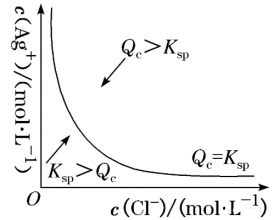 [方法与规律j] 结合图像-变量分析难溶物的沉淀溶解平衡 作者:赵斌 来源:未知 日期:2020-04-08 16:19:46 点击:3599 所属专题:溶解平衡图像
[方法与规律j] 结合图像-变量分析难溶物的沉淀溶解平衡 作者:赵斌 来源:未知 日期:2020-04-08 16:19:46 点击:3599 所属专题:溶解平衡图像
一、解沉淀溶解平衡图像题三步骤 第一步:明确图像中纵、横坐标的含义 纵、横坐标通常是难溶物溶解后电离出的离子浓度。 第二步:理解图像中线上点、线外点的含义 (1)以氯化银为例,在该沉淀溶解平衡图像上,曲线上任意一点都达到了沉淀溶解平衡状态,此时 Q c = K sp 。...
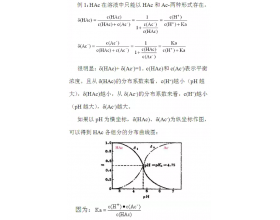 [方法与规律j] 弱酸的分布系数与其酸度的关系 作者:刘凯 来源:GY化学微信公众号 日期:2020-04-02 15:42:33 点击:3973 所属专题:分布曲线
[方法与规律j] 弱酸的分布系数与其酸度的关系 作者:刘凯 来源:GY化学微信公众号 日期:2020-04-02 15:42:33 点击:3973 所属专题:分布曲线
某一存在形式占总浓度的分数,称为该形式的分步系数(摩尔分数),用δ表示。 问题一:一元弱酸的分步系数与其酸度的关系 问题二:二元弱酸的分步系数与其酸度的关系 问题三:三元弱酸的分步系数与其酸度的关系...
 [方法与规律j] 用水解平衡常数理解双水解问题 作者:刘凯 来源:GY化学微信公众号 日期:2020-04-02 15:30:05 点击:1770 所属专题:水解平衡常数 双水解反应
[方法与规律j] 用水解平衡常数理解双水解问题 作者:刘凯 来源:GY化学微信公众号 日期:2020-04-02 15:30:05 点击:1770 所属专题:水解平衡常数 双水解反应
问题一:CH 3 COONH 4 溶液的水解情况怎样 问题二:NH 4 HCO 3 、(NH 4 ) 2 CO 3 溶液的水解情况怎样 问题三:Al 3+ 与HC O 3 - 混合后水解情况怎样 问题四:Al 3+ 与Al O 2 - 混合后水解情况怎样...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
双指示剂法是一种利用两种具有不同变色范围的酸碱指示剂,在...
弱酸也可以制备强酸!!! 比如向 CuSO 4 溶液中加入 H 2 S 溶液生...
氧化还原滴定法: 1.特点: 氧化还原滴定法在药物分析中应用广...
问题1: 在酸溶液中,H + 和OH - 的来源分别是什么?举例说明...
电离平衡常数是高考中一个重要的必考考点,常考查电离平衡常...
...
一、原理:影响水的电离平衡因素 H 2 O H + +OH - 1.25 ℃,...
...