
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
在化学中,离域π键(⼜称⼤π键)是⼀种由三个或更多原⼦共同参与形成的共轭π键。其电⼦不再局限于两个原⼦之间,⽽是在多个原⼦构成的平⾯上离域运动,显著增强分⼦或离⼦的稳定性。这类键⼴泛存在于⽆机含氧酸根、共轭烯烃及芳⾹杂环化合物中。
什么是⼤π键?
⼤π键是由多个原⼦的平⾏p轨道“肩并肩”重叠形成的离域π体系,⽤符号
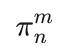
表⽰,其中:
n:参与离域π键的原⼦总数;
m:参与离域的π电⼦总数;
必须满⾜
![]()
与定域π键(如⼄烯中的 C=C )不同,⼤π键中的电⼦在整个共轭⻣架中⾃由分布,使键⻓趋于平均化,并赋予体系额外的稳定性。
形成条件
⼀个稳定的离域π键需同时满⾜以下三点:
1. 共⾯性:所有参与原⼦必须处于同⼀平⾯(或近似共线),以保证p轨道有效平⾏重叠。这通常要求中⼼原⼦为 sp 或 sp2 杂化。
2. p轨道连续:每个参与原⼦必须提供⼀个未⽤于σ键的、垂直于分⼦平⾯的p轨道。
3. 电⼦数适中:参与p轨道中的电⼦总数⼩于轨道数的两倍,确保成键轨道被占据⽽反键轨道空置。
注意:孤对电⼦是否参与π体系,取决于其所在轨道类型——若位于p轨道中,则参与;若位于 p 杂化轨道中,则不参与。
如何计算π电⼦数(m值)?
对于 ABn 型分⼦或离⼦,可使⽤以下公式估算参与⼤π键的电⼦数:
![]()
关键在于准确判断哪些电⼦真正进⼊了离域π系统。
典型分⼦与离⼦的⼤π键分析
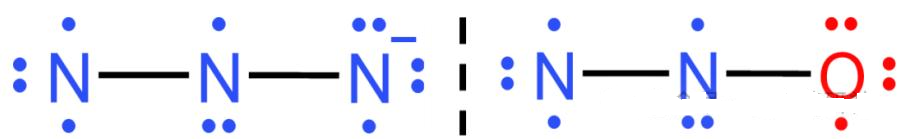
1. ⼆氧化碳(CO₂)
• 结构: O=C=O ,直线形,碳为sp杂化。
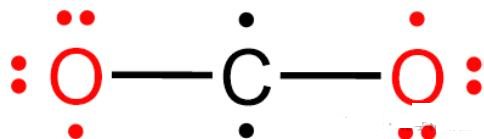
• 三个原⼦( 2O+C )各提供⼀个p轨道,共3个。
• π电⼦数:4。
• 形成 三中⼼四电⼦ ⼤π键: 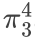
• 等电⼦体: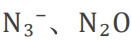
2. 臭氧
• ⻆形结构,中⼼O为sp²杂化,含⼀对孤对电⼦(位于sp²轨道,不参与π键)。
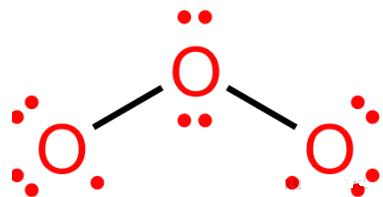
• 三个O原⼦共⾯,各提供⼀个p轨道。
• 总π电⼦数为4。
• 形成 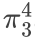
• 等电⼦体: ![]()
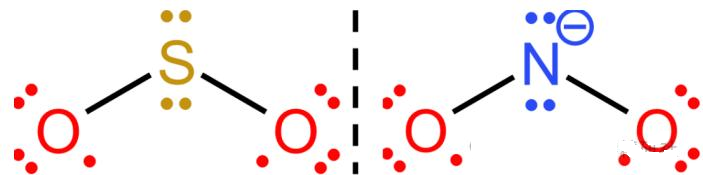
3. 碳酸根离⼦( CO32-)—— 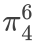
• ⼏何结构:平⾯三⻆形,碳为sp²杂化。
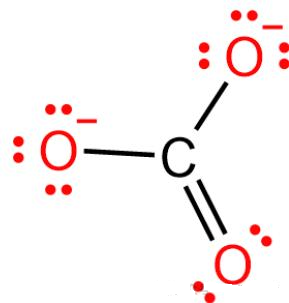
• 四个原⼦全部参与:1个 C+3 个O,每个原⼦都有⼀个垂直于分⼦平⾯的p轨道。

提⽰:类似含氧酸根(如硝酸根、硫酸根的部分结构)多为 n+1 中⼼⼤π键,其中 n 为配位氧原⼦数。
4.苯(C₆H₆)—— 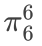
• 六元环完全共⾯,每个碳sp²杂化。
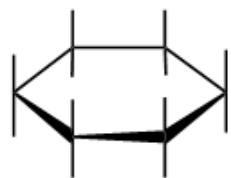
• 6个碳各提供⼀个p轨道,共6个π电⼦。
• 符合休克尔规则( 4n+2 , n-1 ),具有强芳⾹性。
• 电⼦⾼度离域,是经典芳⾹体系。
5.吡啶(C₅H₅N)——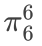
• 六元杂环,N取代⼀个CH。
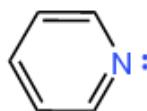
• N为sp²杂化,其孤对电⼦位于 sp2 轨道(不参与π体系),但提供⼀个p轨道。
• 总计6个p轨道( 5C+ 1 N),6个π电⼦
• 具有芳⾹性,但因N电负性⾼,环上电⼦云密度降低。
6.吡咯-----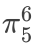
• 五元杂环,N在环中。
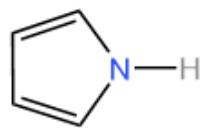
• N的孤对电⼦位于p轨道中,参与π体系,贡献2个电⼦。
• 其余4个碳各贡献1个电⼦ 共6个π电⼦分布在5个原⼦上。
• 形成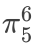 ,符合 休克尔规则(4n+2,n=1 ),具有芳⾹性。
,符合 休克尔规则(4n+2,n=1 ),具有芳⾹性。
7.噻吩—— 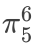
• S原⼦取代吡咯中的N。
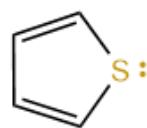
• S的⼀个孤对电⼦进⼊p轨道参与共轭,贡献2个电⼦。
• 总π电⼦数为6,分布在5个原⼦( 4C+S )上;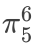
• 同样具有芳⾹性,是药物和材料化学中的重要结构单元
分子/离子 | 大π键类型 | 参与原子 | 芳香性 | 说明 |
CO2 | π43 | C+2O | 否 | 直线形,sp杂化 |
O3 | π43 | 3O | 否 | 角形,有孤对 |
CO32- | π64 | C+3O | 弱/类芳香 | 四中心,键长均等 |
NO3- | π64 | N+3O | 是 | 与CO32-等电子 |
SO3 | π64 | S+3O | 是 | 中性,平面三角 |
苯 | π66 | 6C | 是 | 经典芳香烃 |
吡啶 | π66 | 5C+N | 是 | N孤对不参与π |
吡咯 | π65 | 4C+N | 是 | N孤对参与π |
噻吩 | π65 | 4C+S | 是 | S提供2个π电子 |

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
补充:...
手性分子不一定含有手性碳原子。 判断分子是否具有手性的黄金...
冠醚是一类大环多醚化合物,其分子结构呈环状,环上均匀分布...
在高考备考化学试卷里,经常会遇到含钯的催化剂。本文将就钯...
在离子晶体中存在离子极化现象,使得离子键带有一定共价键的...
【情境】:你注意到我们每天都离不开的水有什么反常之处吗?...