
|
学习小专题 |

|
学习小专题 |
 [注解与辨疑e] 氧原子的杂化类型都有啥? 作者:化学自习室 来源:未知 日期:2025-08-15 18:29:06 点击:164 所属专题:杂化轨道类型
[注解与辨疑e] 氧原子的杂化类型都有啥? 作者:化学自习室 来源:未知 日期:2025-08-15 18:29:06 点击:164 所属专题:杂化轨道类型
氧原子的杂化类型取决于它所处的具体化学环境和成键方式。主要有sp、sp、sp和不杂化四种情况。下面分类阐述总结一下: 1. sp 杂化 (四面体构型) 这是最常见的情况。 例1: 水 (HO)、醇 (R-OH)、醚 (R-O-R) 等分子中与两个原子成键的氧原子均为sp杂化。 解析: 氧原子的...
 [注解与辨疑e] 影响键角大小的因素 作者:化学自习室 来源:未知 日期:2025-08-15 18:07:43 点击:141 所属专题:键角
[注解与辨疑e] 影响键角大小的因素 作者:化学自习室 来源:未知 日期:2025-08-15 18:07:43 点击:141 所属专题:键角
键角(bond angle):是指在分子中,一个原子与其他两个原子形成的两个化学键之间的夹角。键角是反映分子空间结构的重要因素之一。 从原则上说,键角可以用量子力学近似方法计算出来,但对复杂分子,但实际上键角还是通过光谱、衍射等结构实验测定的。 实际上键角是成键电...
 [注解与辨疑e] 等电子原理及应用 作者:化学自习室 来源:未知 日期:2025-08-15 16:17:44 点击:65 所属专题:等电子体
[注解与辨疑e] 等电子原理及应用 作者:化学自习室 来源:未知 日期:2025-08-15 16:17:44 点击:65 所属专题:等电子体
...
 [注解与辨疑e] 影响配合物的稳定性的因素 作者:化学自习室 来源:未知 日期:2025-08-10 09:32:34 点击:193 所属专题:配合物稳定性
[注解与辨疑e] 影响配合物的稳定性的因素 作者:化学自习室 来源:未知 日期:2025-08-10 09:32:34 点击:193 所属专题:配合物稳定性
...
 [注解与辨疑e] 不同价电子对数下的分子构型汇总 作者:化学自习室 来源:未知 日期:2025-08-07 11:18:49 点击:94 所属专题:价层电子对互斥理论
[注解与辨疑e] 不同价电子对数下的分子构型汇总 作者:化学自习室 来源:未知 日期:2025-08-07 11:18:49 点击:94 所属专题:价层电子对互斥理论
价电子对数 分子构型 键角 杂化方式 分子几何构型 实例 2 直线形 180° sp杂化 CO 2 、BeCl 2 3 +0 平面三角形 120° sp 2 杂化 BF 3 2+1 V形 120° sp 2 杂化 SnBr 2 4+0 正四面体 109.5 ° sp 3 杂化 CH 4 3+1 三角锥形 1 07 ° sp 3 杂化 NH 3 2+2 V形 1 05 ° sp 3 ...
 [注解与辨疑e] 四氨合铜离子的空间结构为什么是平面正方形? 作者:化学自习室 来源:未知 日期:2025-08-06 10:33:01 点击:159 所属专题:铜氨
[注解与辨疑e] 四氨合铜离子的空间结构为什么是平面正方形? 作者:化学自习室 来源:未知 日期:2025-08-06 10:33:01 点击:159 所属专题:铜氨
...
 [注解与辨疑e] 范德华力与分子极性有什么关系? 作者:化学自习室 来源:未知 日期:2025-08-06 09:57:26 点击:163 所属专题:分子间作用力 分子极性
[注解与辨疑e] 范德华力与分子极性有什么关系? 作者:化学自习室 来源:未知 日期:2025-08-06 09:57:26 点击:163 所属专题:分子间作用力 分子极性
...
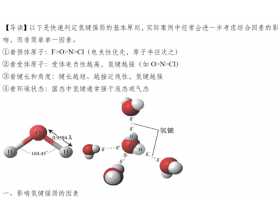 [注解与辨疑e] 如何比较氢键的强弱? 作者:化学自习室 来源:未知 日期:2025-08-06 09:22:54 点击:160 所属专题:氢键强弱
[注解与辨疑e] 如何比较氢键的强弱? 作者:化学自习室 来源:未知 日期:2025-08-06 09:22:54 点击:160 所属专题:氢键强弱
...
 [注解与辨疑e] 什么是共轭π键? 作者:化学自习室 来源:未知 日期:2025-08-06 09:14:37 点击:177 所属专题:大π键
[注解与辨疑e] 什么是共轭π键? 作者:化学自习室 来源:未知 日期:2025-08-06 09:14:37 点击:177 所属专题:大π键
...
 [注解与辨疑e] 配位数等于配体数吗?配位原子数与中心原子直接成键的原子数? 作者:化学自习室 来源:未知 日期:2025-08-06 09:14:20 点击:159 所属专题:配合物配位数
[注解与辨疑e] 配位数等于配体数吗?配位原子数与中心原子直接成键的原子数? 作者:化学自习室 来源:未知 日期:2025-08-06 09:14:20 点击:159 所属专题:配合物配位数
...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。...
...
价电子对数 分子构型 键角 杂化方式 分子几何构型 实例 2 直线形 180° sp杂化 CO 2 ...
...
...
氢键形成时所放出的能量,称为氢键的键能。氢键键能的大小,与X和Y的电负性大小有关,...
【导读】 以下是快速判定氢键强弱的基本原则,实际案例中经常会进一步考虑综合因素的...
...