
|
学习小专题 |

|
学习小专题 |
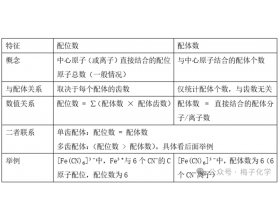 [注解与辨疑e] 配位数和配体数概念辨析 作者:化学自习室 来源:未知 日期:2025-03-25 09:32:01 点击:143009 所属专题:配位数
[注解与辨疑e] 配位数和配体数概念辨析 作者:化学自习室 来源:未知 日期:2025-03-25 09:32:01 点击:143009 所属专题:配位数
一、概念辨析 1. 区别与联系 注:配位数和配位键之间没有直接的、必然的关系。 2. 典型实例分析 ( 1 )单齿配体(配位数 = 配体数) 例如: [Co(NH ) ] 中,配体数 =6 ,有 6 个 NH 分子(每个 NH 是单齿配体)。 配位数 =6 ,每个 NH 提供 1 个 N 原子与 Co 结合。 所...
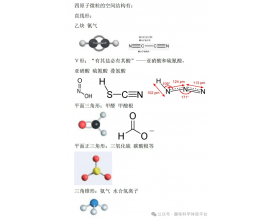 [注解与辨疑e] 四原子微粒的空间结构 作者:化学自习室 来源:未知 日期:2025-03-24 15:47:22 点击:226 所属专题:分子空间结构
[注解与辨疑e] 四原子微粒的空间结构 作者:化学自习室 来源:未知 日期:2025-03-24 15:47:22 点击:226 所属专题:分子空间结构
...
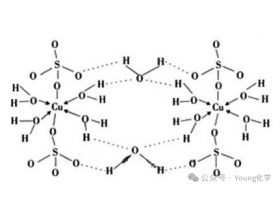 [注解与辨疑e] 五水硫酸铜晶体中的化学键 作者:化学自习室 来源:未知 日期:2025-03-11 08:08:12 点击:507 所属专题:硫酸铜
[注解与辨疑e] 五水硫酸铜晶体中的化学键 作者:化学自习室 来源:未知 日期:2025-03-11 08:08:12 点击:507 所属专题:硫酸铜
五水硫酸铜晶体( CuSO45H2O )中存在多种化学键,主要包括: 离子键 存在位置: 铜离子 (Cu2+)和硫酸根离子(SO42)之间。 形成原因: Cu2+带正电荷, SO42带负电荷,它们之间由于静电引力形成离子键。 配位键 存在位置:铜离子( Cu2+)与四个水分子之间。 形成原因...
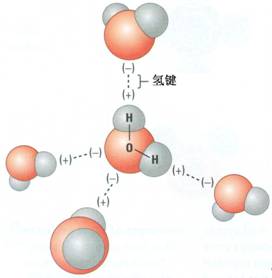
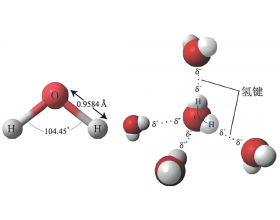 [注解与辨疑e] 如何比较氢键的强弱? 作者:化学自习室 来源:未知 日期:2025-08-06 09:30:08 点击:1137 所属专题:氢键强弱
[注解与辨疑e] 如何比较氢键的强弱? 作者:化学自习室 来源:未知 日期:2025-08-06 09:30:08 点击:1137 所属专题:氢键强弱
【导读】 以下是快速判定氢键强弱的基本原则,实际案例中经常会进一步考虑综合因素的影响,而非简单单一因素。 ①看供体原子 : FONCl (电负性优先,原子半径次之) ②看受体原子 : 受体电负性越高,氢键越强(如 ONCl ) ③看键长和角度 : 键长越短、越接近线性,氢...
 [注解与辨疑e] 二氧化氯按照价电子互斥理论是3.5,而实际上Cl是sp2杂化? 作者:化学自习室 来源:未知 日期:2025-03-03 16:12:08 点击:1276 所属专题:二氧化氯
[注解与辨疑e] 二氧化氯按照价电子互斥理论是3.5,而实际上Cl是sp2杂化? 作者:化学自习室 来源:未知 日期:2025-03-03 16:12:08 点击:1276 所属专题:二氧化氯
根据价电子互斥理论, ClO 2 中氯原子周围的价电子对数计算为 3.5,理论上应倾向于 sp 3 杂化。然而,实际情况是氯原子采用 sp 2 杂化,这可以通过以下几点来理解: 大π键的形成:在 ClO 2 分子中,氯原子与两个氧原子之间可以形成三中心五电子的大π键。这种大π键的形成...
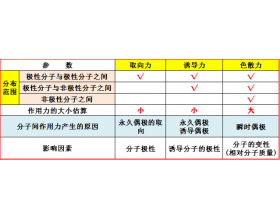 [注解与辨疑e] 范德华力与分子极性有什么关系? 作者:化学自习室 来源:未知 日期:2025-02-27 09:10:47 点击:817 所属专题:范德华力 分子极性
[注解与辨疑e] 范德华力与分子极性有什么关系? 作者:化学自习室 来源:未知 日期:2025-02-27 09:10:47 点击:817 所属专题:范德华力 分子极性
【导读】分子间作用力(范德华力)的来源是取向力、诱导力和色散力。 ①一般情况下,极性分子与极性分子之间,取向力、诱导力、色散力都存在; ②极性分子与非极性分子之间,则存在诱导力和色散力; ③非极性分子与非极性分子之间,则只存在色散力。 分子间作用力(范德华...
 [注解与辨疑e] 哪些轨道可以形成π键? 作者:化学自习室 来源:未知 日期:2025-02-20 10:09:18 点击:1500 所属专题:π键
[注解与辨疑e] 哪些轨道可以形成π键? 作者:化学自习室 来源:未知 日期:2025-02-20 10:09:18 点击:1500 所属专题:π键
常见形成π键的轨道如下: p-p π键:最常见,如乙烯、氧气 d-p π键:常见于过渡金属配合物,如四羰基合镍 d-d π键:常见于某些金属化合物,如八氯化二铼 f-d π键:较少见,某些锕系元素的配合物中理论上存在 离域π键(大π键):常见于多原子分子,如苯、吡啶、二氧化硫 1. p-...
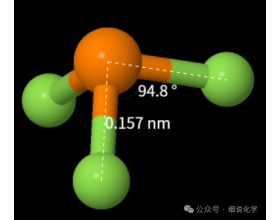 [注解与辨疑e] PH3与PF3键角大小比较 作者:化学自习室 来源:未知 日期:2025-02-18 17:16:45 点击:946 所属专题:键角
[注解与辨疑e] PH3与PF3键角大小比较 作者:化学自习室 来源:未知 日期:2025-02-18 17:16:45 点击:946 所属专题:键角
PH3与PF3两者中心原子杂化方式及孤对电子数都相同,F原子的电负性比H的电负性更大,P-F成键电对靠近氟原子P,理论上应是PH3键角大于PF3,但事实上确完全相反, 查阅资料,发现PH3键角小于PF3,PF3分子中由于F原子上的孤对电子对占有P原子的3d空轨道, 形成p-dπ配键,增...
 [注解与辨疑e] 硫氰根(SCN⁻)形成配位键的,给出孤电子对的是S还是N? 作者:化学自习室 来源:未知 日期:2025-02-18 15:44:27 点击:2273 所属专题:配体
[注解与辨疑e] 硫氰根(SCN⁻)形成配位键的,给出孤电子对的是S还是N? 作者:化学自习室 来源:未知 日期:2025-02-18 15:44:27 点击:2273 所属专题:配体
硫氰根离子(SCN)与金属离子形成配位键时,硫原子和氮原子都有可能给出电子对。 当和一些软酸型金属离子(如Hg)配位时,主要是硫原子给出电子对。这是因为软酸型金属离子易与半径较大、易变形的配位原子(如硫原子)结合,硫原子的外层电子云相对更易变形,更易与这类金属离子形...
 [注解与辨疑e] 配位化合物的命名与书写 作者:化学自习室 来源:未知 日期:2024-09-05 10:38:38 点击:1391 所属专题:配合物命名
[注解与辨疑e] 配位化合物的命名与书写 作者:化学自习室 来源:未知 日期:2024-09-05 10:38:38 点击:1391 所属专题:配合物命名
配位化合物的命名服从一般无机化合物的命名原则。从右到左,为“某化某”(阴离子为简单离子)或“某酸某”(阴离子为复杂离子),具体方法如下: 如果配位化合物由内界配位离子和外界离子组成, 当配位离子为阳离子,先命名外界阴离子。某化(或某酸)+配位离子名称; 当配位离...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。...
...
价电子对数 分子构型 键角 杂化方式 分子几何构型 实例 2 直线形 180° sp杂化 CO 2 ...
...
...
氢键形成时所放出的能量,称为氢键的键能。氢键键能的大小,与X和Y的电负性大小有关,...
【导读】 以下是快速判定氢键强弱的基本原则,实际案例中经常会进一步考虑综合因素的...
...