
|
学习小专题 |

|
学习小专题 |
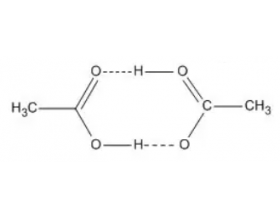 [注解与辨疑e] 细说高中化学中超分子的两个特性:分子识别和自组装 作者:化学自习室 来源:未知 日期:2025-07-30 08:33:28 点击:207 所属专题:超分子
[注解与辨疑e] 细说高中化学中超分子的两个特性:分子识别和自组装 作者:化学自习室 来源:未知 日期:2025-07-30 08:33:28 点击:207 所属专题:超分子
关于超分子 由两种或两种以上的分子通过分子间相互作用形成的分子聚集体。 乙酸二聚体 分子聚集体有的是有限的,有的是无限伸展的。超分子中分子的定义是广义的,也包括聚合体离子。 超分子比较复杂,但有一定的组织和完整性,具有明确的微观结构和宏观特性。 超分子中...
 [注解与辨疑e] 键角大小比较反常:三氯化磷大于三氟化磷 作者:化学自习室 来源:未知 日期:2025-07-03 17:06:55 点击:216 所属专题:键角
[注解与辨疑e] 键角大小比较反常:三氯化磷大于三氟化磷 作者:化学自习室 来源:未知 日期:2025-07-03 17:06:55 点击:216 所属专题:键角
[2025湖北新八校2月卷] 8 . 从微观视角探析物质结构及性质是学习化学的有效方法。下列对事实的解释错误的是 选项 事实 解释 A 甘油是黏稠液体 甘油分子间存在氢键 B 键角PH 3 <PF 3 成键电子对离P越远,成键电子对间的斥力一定越小 C 乙醛羟醛缩合反应的产物为CH 3 CH=...
 [注解与辨疑e] 含N化合物的杂化分析 作者:化学自习室 来源:未知 日期:2025-06-23 09:21:22 点击:345 所属专题:杂化轨道类型
[注解与辨疑e] 含N化合物的杂化分析 作者:化学自习室 来源:未知 日期:2025-06-23 09:21:22 点击:345 所属专题:杂化轨道类型
含氮(N)的杂化化合物是指氮原子通过轨道杂化形成化学键的化合物。氮原子的电子构型为1s2s2p,在形成化合物时,其2s和2p轨道会发生杂化,形成不同类型的杂化轨道,进而影响分子的结构、性质和反应活性。以下从氮原子的杂化类型出发,结合典型化合物展开说明: 一、氮原...
 [注解与辨疑e] 共价键的均裂和异裂主导因素是什么? 作者:化学自习室 来源:未知 日期:2025-06-17 06:54:59 点击:360 所属专题:共价键
[注解与辨疑e] 共价键的均裂和异裂主导因素是什么? 作者:化学自习室 来源:未知 日期:2025-06-17 06:54:59 点击:360 所属专题:共价键
在化学中均裂和异裂是共价键的断裂的两种主要方式,其决定因素不同:均裂主要由键能决定,键能越低,越容易发生断裂。异裂主要由极性决定,极性越强,越容易发生异裂。 均裂是指共价键断裂时,成键的一对电子平均分配给两个原子或基团,每个原子或基团各得到一个电子,...
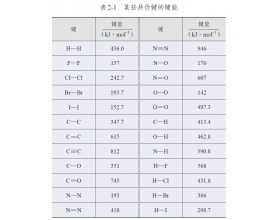 [注解与辨疑e] 键能大小比较有反常:为什么F-F键键能反常? 作者:化学自习室 来源:未知 日期:2025-05-29 09:03:49 点击:227 所属专题:键能
[注解与辨疑e] 键能大小比较有反常:为什么F-F键键能反常? 作者:化学自习室 来源:未知 日期:2025-05-29 09:03:49 点击:227 所属专题:键能
通常而言,同主族元素形成的X-X键,自上而下,键长逐渐增大,键能逐渐降低。 根据元素周期表的信息可知,F是ⅦA族最上方的元素,且F-F的键长较短,按理说键能应该较高,但实际上根据人教版选择性必修二中提供的数据可以看出F-F出现明显反常,反常的低。 共价键 H-H F-F ...
 [注解与辨疑e] 键角比较大小有反常:磷化氢与三氟化磷 作者:化学自习室 来源:未知 日期:2025-05-29 08:52:05 点击:299 所属专题:键角
[注解与辨疑e] 键角比较大小有反常:磷化氢与三氟化磷 作者:化学自习室 来源:未知 日期:2025-05-29 08:52:05 点击:299 所属专题:键角
比较键角的大小一般我们分为三步:①中心原子的杂化方式②孤电子对③原子电负性大小 例如:⑴SO 3 与S O 4 2 - 由于SO 3 中心原子S杂化方式为sp 2 ,S O 4 2 - 中心S原子杂化方式sp 3 ,因此SO 3 键角大于S O 4 2 - ⑵H 2 O与NH 3 键角大小比较:两者中心原子杂化方...
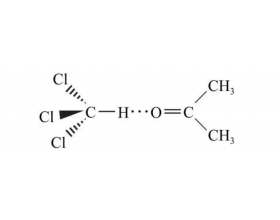 [注解与辨疑e] 除氮、氧、氟外其他元素能形成氢键吗? 作者:化学自习室 来源:未知 日期:2025-05-12 15:48:54 点击:222 所属专题:氢键
[注解与辨疑e] 除氮、氧、氟外其他元素能形成氢键吗? 作者:化学自习室 来源:未知 日期:2025-05-12 15:48:54 点击:222 所属专题:氢键
能否形成氢键的“视点”:一看有无电负性...
 [注解与辨疑e] 氢键的强弱比较 作者:化学自习室 来源:未知 日期:2025-08-06 09:29:45 点击:781 所属专题:氢键强弱
[注解与辨疑e] 氢键的强弱比较 作者:化学自习室 来源:未知 日期:2025-08-06 09:29:45 点击:781 所属专题:氢键强弱
一、知识梳理 (一)影响氢键强弱的因素 1. 供体原子的电负性:电负性越高,对H的极化作用越强,氢键越强。 电负性顺序:F(4.0)O(3.5)N(3.0) 氢键强度顺序:F-H…FO-H…ON-H…N 2.受体原子的电负性:受体原子电负性越高,越容易吸引H的δ+电荷,氢键越强。 例如:O-H…O...
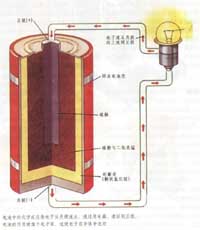 [注解与辨疑e] 氨和水中有多少氢键?氨水中氢键主要存在形式是什么? 作者:化学自习室 来源:未知 日期:2025-04-18 10:10:34 点击:488 所属专题:氨水 氢键
[注解与辨疑e] 氨和水中有多少氢键?氨水中氢键主要存在形式是什么? 作者:化学自习室 来源:未知 日期:2025-04-18 10:10:34 点击:488 所属专题:氨水 氢键
1mol 氨中氢键数量分析 一、氢键形成机制 NH分子结构 H原子作为氢键供体(需与高电负性原子如N、O、F结合);孤对电子作为氢键受体(存在于另一分子中)。 每个NH分子含3个N-H键和一个孤对电子位于N原子上。 二、不同状态下氢键数量 1、固态氨(晶体) 理想情况:每个NH分子...
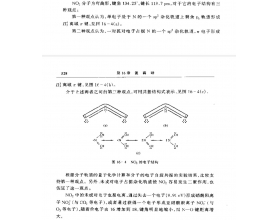 [注解与辨疑e] 二氧化氮的氮原子是什么杂化? 作者:化学自习室 来源:未知 日期:2025-04-14 10:51:20 点击:1067 所属专题:二氧化氮
[注解与辨疑e] 二氧化氮的氮原子是什么杂化? 作者:化学自习室 来源:未知 日期:2025-04-14 10:51:20 点击:1067 所属专题:二氧化氮
二氧化氮(NO)中氮原子的杂化类型为 sp杂化,具体分析如下: 1.计算 n (的价层电子对数) =2+1/2(5-2×2)=2.5 注意:这里的0.5对即单电子,根据VSePr理论,单电子视为一个“等效电子对”,因此氮原子的价层电子对总数为 3对(2个σ键电子对 + 1个单电子等效对)。 2. 杂...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。...
...
价电子对数 分子构型 键角 杂化方式 分子几何构型 实例 2 直线形 180° sp杂化 CO 2 ...
...
...
氢键形成时所放出的能量,称为氢键的键能。氢键键能的大小,与X和Y的电负性大小有关,...
【导读】 以下是快速判定氢键强弱的基本原则,实际案例中经常会进一步考虑综合因素的...
...