
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
二氧化氮(NO₂)中氮原子的杂化类型为 sp²杂化,具体分析如下:
1.计算N的价层电子对数
=2+1/2(5-2×2)=2.5
注意:这里的0.5对即单电子,根据VSEPR理论,单电子视为一个“等效电子对”,因此氮原子的价层电子对总数为 3对(2个σ键电子对 + 1个单电子等效对)。
2. 杂化轨道类型判断
当中心原子的价层电子对总数为3时,需要 3个杂化轨道,对应 sp²杂化(1个s轨道与2个p轨道杂化,形成3个能量相等的sp²杂化轨道)。
这3个sp²杂化轨道中:
2个轨道与氧原子的P轨道形成 σ键,1个轨道容纳 单电子(或单电子对)。
3. 分子空间构型
NO₂的空间构型为 V形(角形),键角约为134°,符合sp²杂化的特征(电子对呈平面三角形分布,单电子对占据一个顶点,导致分子弯曲)。
拓展:
N原子未参与杂化的p轨道(含2个电子)与两个氧原子的未杂化的p轨道形成大π键(Π34),进一步稳定分子结构。
结论:
二氧化氮中氮原子的杂化类型为 sp²杂化,其杂化方式由价层电子对数目(3对)决定,最终形成V形分子结构。
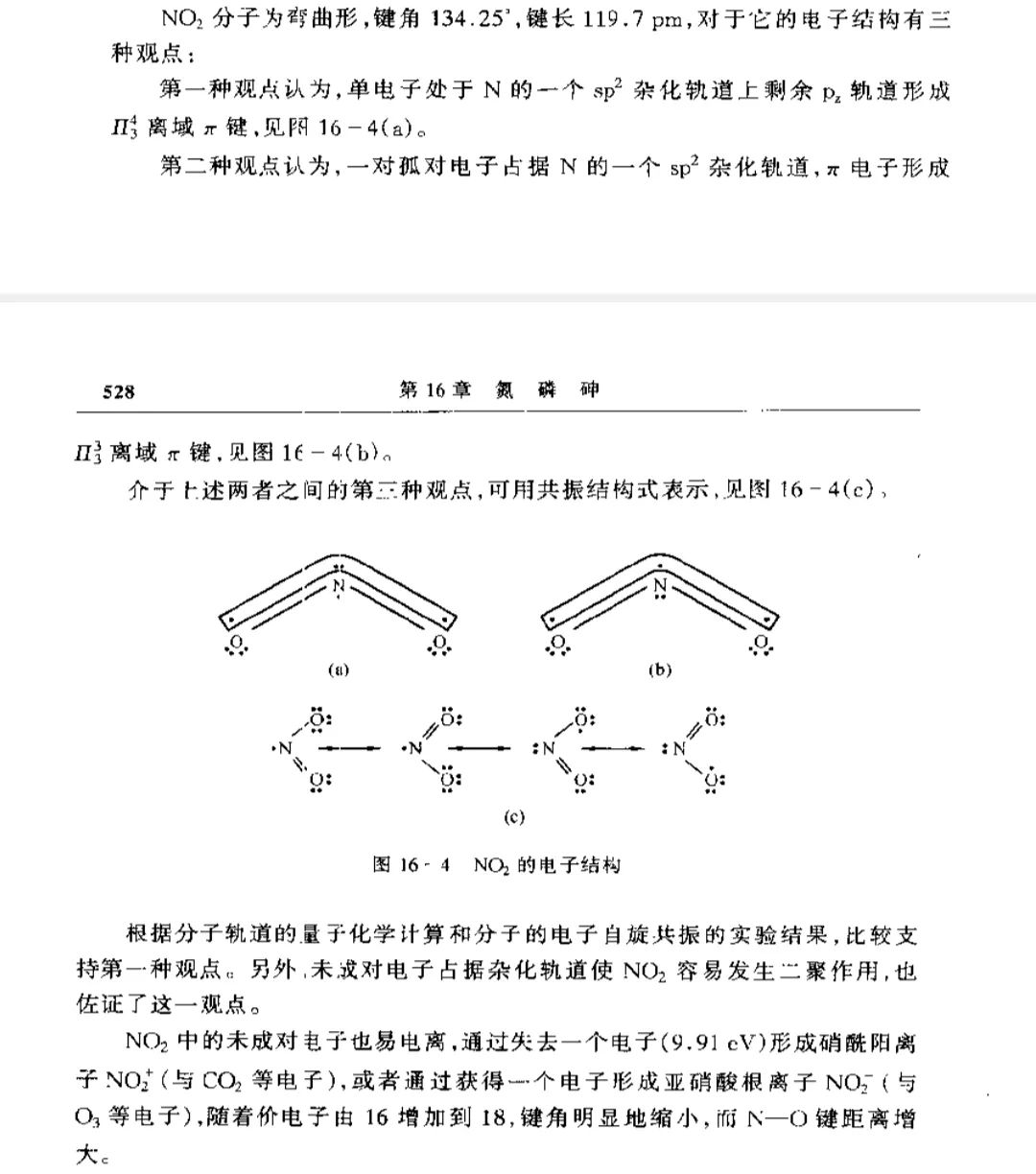
以下图片为《蓝皮》原文,是一个历史遗留问题

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。通常而言,同主族元素形成的X-X键,自上而下,键长逐渐增大,键能逐渐降低。 根据元素...
无机化学实验是一门与无机化学理论课密切配合的课程。实验用化学事实充实了理论课的学...
能否形成氢键的“视点”:一看有无电负性...
1mol 氨中氢键数量分析 一、氢键形成机制 NH分子结构 H原子作为氢键供体(需与高电负性...
二氧化氮(NO)中氮原子的杂化类型为 sp杂化,具体分析如下: 1.计算 n (的价层电子对数...
...