
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
NO2可以说是化学教学中一个璀璨夺目的明星分子,它的知名度不亚于H2、O2、Cl2、CO2,可是我们对它的了解还比较肤浅,不够深刻,有的甚至有误解。以下几个值得注意的问题想必可以说明这一点。
一、通常情况下不可能有纯的NO2
大家知道,中学化学教材中多次出现有2NO2<=>N2O4的可逆反应;大学教材中更标明了这个可逆反应温度范围(264K-413K),温度低于0℃时,几乎只有N2O4,温度高于140℃时,又几乎只有NO2(高于150℃,NO2分解成NO、O2)。
再从手册上可以查到N2O4在不同温度下的离解度:
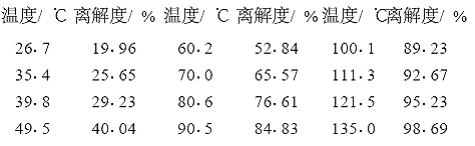
可见,通常情况下不可能有纯的NO2,只有NO2和N2O4的反应平衡混合物存在。比如,室温下NO2的含量还不到平衡混合物组成的1/5。
二、不能用浓H2SO4来干燥NO2
用浓H2SO4来干燥NO2的练习、试题早已频频出现在各种高中化学复习资料中,这是一个明显的科学性错误。想必读者都有条件做如图1所示的实验。
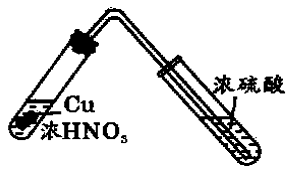
图1实验装置
你会发现:
第一,如此浓烈的红棕色NO2气流经过浓H2SO4后竟是有进无出,没有一点外逸。
第二,开初,浓H2SO4吸收NO2以后,浓H2SO4没有颜色变化,稍后吸收更多的NO2以后,浓H2SO4显浅的棕黄色。
第三,在棕黄色的浓H2SO4中放入一块Cu片,明显地观察到Cu的反应(溶解)。
第四,把吸收了NO2的棕黄色浓H2SO4加热,还不到沸腾以前,就有大量被溶解的NO2被解吸出来。
综上可见,NO2不能用浓H2SO4来干燥。
NO2之所以能被浓H2SO4强烈吸收,主要基于以下的原因:
一是化学吸收。NO2与浓H2SO4反应生成含硝硫酸(NO)HSO4(又称亚硝基硫酸)。
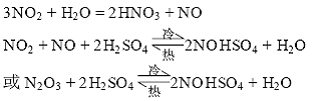
二是物理吸收。NO2、NO等以分子的形式溶解在浓H2SO4中,所以吸收了较多NO2的浓硫酸有明显的棕黄色。
三、NO2溶于水的体积变化为什么跟“3NO2+H2O=2HNO3+NO”相去甚远
大家知道,高中化学讲硝酸一节曾有这样的习题:“用大量筒收集一筒二氧化氮气体,倒扣在盛水的水槽里,一会儿看到量筒里红棕色气体消失,量筒里水面上升到量筒容积的2/3”事实上水面上升远远大于量筒容积的2/3。
我认为,原来我们通常用Cu与浓HNO3反应制得的所谓NO2,实际主要成分是无色的N2O4,它的体积分数不低于80%,真正的NO2不到20%,还有少量的NO,如果按3NO2+H2O=2HNO3+NO,水位当上升到量筒容积的2/3;但按3N2O4+2H2O=4HNO3+2NO,水位则当上升到量筒容积的1/3。
根据上面两个反应,无论如何都解释不了水面上升远远高于量筒容积2/3的事实。可见,事实的背后还有更深层次的原因,那就是上述反应生成的NO远没有到此为止,而是进一步消耗在与NO2发生了如下反应:
NO+NO2+H2O=2HNO2 或N2O3+H2O=2HNO2
显然,上列习题的编拟者忽略了这个不应该忽略的事实(水面上升远远高于量筒容积的2/3),过分地把复杂问题简单化了。
四、NO2何以能使余烬木条复燃
学生都知道纯O2能使余烬木条复燃,其实浓度较大的NO2也能使余烬木条复燃,这是因为余烬所提供的温度(高温)可以使NO2分解:2NO2=2NO+O2(>150℃),可见余烬在NO2中复燃是NO2分解生成的O2所致。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。二氧化硫与硫化钠溶液反应时,根据反应条件特别是二氧化硫的量的不同,可能产生不同的...
1、问题来源 2023年浙江6月选考T9 D.向硫化钠溶液通入足量二氧化硫: 因为硫离子和二...
...
浓硫酸与稀硫酸的分界线 我们所说的具有典型吸水性、脱水性和强氧化性的浓硫酸,指的...
稀硝酸比 浓硝酸 更稳定,不能够简单的理解浓度因素,实际上硝酸浓度越高,越不稳定,...
HSCN有硫氰酸(H - S - C ≡ N)和异硫氰酸(H - N = C = S)两种结构;但硫氰酸结构...