
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!

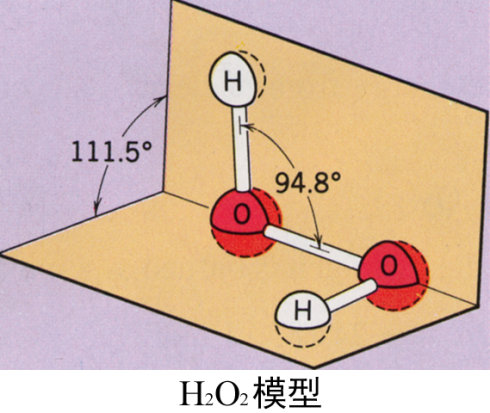
过氧化氢H2O2能以任意比与水混合,其分子间因具有较强氢键,故在液态、固态中存在缔合分子而使之具有较高的熔点(272K)和沸点(423K),其化学性质可归纳为:氧化性、还原性、弱酸性和不稳定性.
过氧化氢溶液,俗称双氧水,为无色无味的液体,它的性质比较复杂,在习题中主要表现它的不稳定性、酸性、氧化性和还原性,学生掌握起来比较困难,现总结如下:
H2O2中O呈-1价,属于0价和-2价之间的中间价态,H2O2表现为既有氧化性又有还原性,遇到强氧化剂时呈现还原性,遇到强还原剂时呈现氧化性,并以氧化性为主。
(1)氧化性:H2O2做氧化剂时,其还原产物为H2O,不会引入新的杂质,这是H2O2被称为环保型氧化剂的原因。如:H2O2+SO2=H2SO4;2FeSO4+ H2O2+H2SO4=Fe2(SO4)3+2H2O
【例1】使用假冒伪劣化妆品,脸上有时会出现一些黑色斑点。这主要是伪劣化妆品里含有铅白2PbCO3·Pb(OH)2与皮肤中的硫化物产生黑色硫化铅的缘故。除去这种黑色斑点的主要方法是选用合宜的氧化剂将其氧化为难溶于水和酸的白色化合物。
供选择的氧化剂有:①漂白粉 ②高锰酸钾 ③H2O2(双氧水),试回答:
(1)应选用何种氧化剂去掉PbS,是 。
(2)去掉PbS时可能的化学方程式是 。
解析:首先看清题意是将黑色的硫化铅氧化为难溶于水和酸的白色化合物。铅盐中PbSO3为白色但溶于酸,PbSO4是不溶于水和酸的白色化合物。由此可知PbS中的S2-氧化成SO42-在这个过程中显然要有氧。再从几种供选用的氧化剂考虑,不应该在脸上使用漂白粉,因为它会腐蚀皮肤。若用消毒剂KMnO4虽然能使PbS氧化,但人的皮肤近中性,KMnO4的还原产物不是Mn2+盐而是MnO2,MnO2显黑褐色比PbS更难消除,显然也不行。而H2O2的还原产物是H2O,是合理的选择。
答案:(1)选用适宜浓度的H2O2溶液。H2O2把PbS氧化成PbSO4而不留下其他难以消除的固体,也不会对人体产生危害。
(2)PbS + 4H2O2 == PbSO4 + 4H2O
(2)还原性:H2O2做还原剂时,其氧化产物为O2 ,如:2KMnO4+5H2O2+3H2SO4=2MnsO4+K2SO4+5O2↑+8H2O
【例2】把双氧水加入酸化的KMnO4溶液中,溶液的紫红色消失,此时双氧水表现出性,反应的离子方程式为
解析:双氧水加入酸化的KMnO4溶液中,溶液的紫红色消失,此时双氧水表现出还原性,反应的离子方程式为2MnO4- +6H+ +5H2O2 =2Mn2+ +5O2↑+8H2O
答案:还原性,2MnO4- +6H+ +5H2O2 =2Mn2+ +5O2↑+8H2O
(3)不稳定性:在常温下,它的分解缓慢,90%的H2O2溶液在323K下每小时只分解0.001%,但若溶液中存在Fe2+、Mn2+、Cu2+、Cr3+、CO2+等杂质,则能加快其分解,波长为320-380nm的光也能大大加快H2O2的分解,因此,H2O2溶液应保存在避光的棕色瓶中并置放于阴凉处。
2H2O2 = 2H2O +O2↑
实验室常用此反应制取氧气。
【例3】下列反应适用于实验室制备氧气的是( )
①高锰酸钾热分解 2KMnO4=K2MnO4+MnO2+O2↑
②硝酸铵热分解 NH4NO3=4H2O+2N2↑+O2↑
③过氧化氢分解 2H2O2=2H2O+O2↑
④二氧化氮的分解 2NO2=2NO+O2↑
A.只有① B.①和② C.①和③ D.①③④
答案: C
(4)弱酸性:过氧化氢呈弱酸性,相当于二元弱酸,电离方程式:H2O2![]() H+ + HO2-, HO2-
H+ + HO2-, HO2-![]() H+ + O22-,在298K时,它的第一级电离常数K1=1.55×10-12 其K2很小,约为10-25,H2O2是一种弱酸。
H+ + O22-,在298K时,它的第一级电离常数K1=1.55×10-12 其K2很小,约为10-25,H2O2是一种弱酸。
【例4】双氧水(H2O2)和水都是极弱电解质,但H2O2比H2O更显酸性。
①若把H2O2看成是二元弱酸,请写出它在水中的电离方程式:
②鉴于H2O2显弱酸性,它能同强碱作用形成正盐,在一定条件下也可形成酸式盐。请写出H2O2与Ba(OH)2作用形成正盐的化学方程式:
③水电离生成H3O+和OH-叫做水的自偶电离。同水一样,H2O2也有极弱的自偶电离,其自偶电离的方程式为:
解析:①多元弱酸分步电离,酸分子中的氢原子分步被以氢离子的形式电离出来。
H2O2![]() H+ + Ho2-, HO2-
H+ + Ho2-, HO2-![]() H+ + O22-;
H+ + O22-;
从电离的结果来看,H2O2被看成是二元弱酸时,有酸式酸根离子HO2-和酸根离子O22-。
②H2O2被看成是二元弱酸时,酸根离子为O22-,与Ba(OH)2作用形成正盐的化学式为BaO2 。H2O2与Ba(OH)2作用形成正盐的化学方程式:H2O2 +Ba(OH)2 =BaO2 +2H2O 。
③水电离生成H3O+和OH-叫做水的自偶电离,电离方程式为:H2O + H2O![]() H3O+ + OH- ,书写该电离方程式时的关键是其中一个水分子与水电离出来的氢离子结合成水合氢离子。同水一样,H2O2也有极弱的自偶电离,电离书写式的关键是其中一个双氧水分子与双氧水电离出来的一个氢离子结合成双氧水合氢离子:H2O2 + H2O2
H3O+ + OH- ,书写该电离方程式时的关键是其中一个水分子与水电离出来的氢离子结合成水合氢离子。同水一样,H2O2也有极弱的自偶电离,电离书写式的关键是其中一个双氧水分子与双氧水电离出来的一个氢离子结合成双氧水合氢离子:H2O2 + H2O2![]() H3O2++ HO2-。
H3O2++ HO2-。
答案:①H2O2![]() H+ + HO2-, HO2-
H+ + HO2-, HO2-![]() H+ +O22-
H+ +O22-
②H2O2 +Ba(OH)2 = BaO2 +2 H2O
③H2O2 + H2O2![]() H3O2++ HO2-
H3O2++ HO2-
【例5】将H2O2溶液滴入含有酚酞的NaOH溶液中,红色消失。甲同学认为这是由于H2O2是二元弱酸(H2O2![]() H++ HO2-),消耗了OH-,而是红色褪去。乙同学认为H2O2具有了强氧化性,将酚酞氧化,红色消失。试设计一个试验论证甲乙两位同学的解释中谁正确。
H++ HO2-),消耗了OH-,而是红色褪去。乙同学认为H2O2具有了强氧化性,将酚酞氧化,红色消失。试设计一个试验论证甲乙两位同学的解释中谁正确。
答案:将上述溶液(红色消失后的溶液)取少量加入一支洁净的试管中,在试管中滴入氢氧化钠溶液,如果再出现红色,则为H2O2酸性所致,甲同学的见解正确;如果不再出现红色,则为酚酞被H2O2氧化所致,乙同学的见解正确。
通过上述对过氧化氢性质的分析,及时巩固所学知识,加深对概念原理的理解,提高分析问题和解决问题的能力,对练习的正确处理是强化学生学习薄弱的环节、清晰模糊的概念、纠正错误的知识点的主要途径,是培养学生迁移发散等综合能力的有效方法。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。一、拟卤素 1、涵义 某些原子团形成的分子,与卤素单质分子的性质相似,它们的阴离子...
一、 心概念与知识网络 “反应历程”或“反应机理”是近年来高考化学的热点。它不再是...
一、硫和金单质的反应 据我国古代第一部药物学专著《神农本草经》记载:“石硫黄(即硫...
高价态的含氧酸酸性强于低价态含氧酸的酸性,那么氧化性呢?比如,亚硝酸的氧化性就强...
...
浓硫酸和浓硝酸都具有氧化性,那么它俩谁更强呢?首先,必须确保同浓度下,水溶剂体系...