
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
在中学教科书中有这样两个化学方程式:
Cu + 4HNO3(浓) ===Cu(NO3)2+ 2NO2↑+ 2H2O
3Cu + 8HNO3(稀) ===3Cu(NO3)2+ 2NO↑+ 4H2O
可见,浓硝酸的还原产物是NO2,稀硝酸的还原产物是NO。不少同学认为这两个反应的反应物相同,只是硝酸的浓度不同,反应的结果:第一个反应中N被还原成了N;而第二个反应中N被还原成了N。由此得出稀硝酸的氧化性比浓硝酸的氧化性强的错误结论。
一般说来,硝酸氧化性的强弱并不是根据硝酸(实际是N)被还原的产物的化合价改变的大小来决定的,而是由硝酸的浓度来决定的,硝酸越浓,它的氧化能力就越强。例如:
(1)稀硝酸与硫化物反应时,只能将S2- 离子氧化成单质硫,而浓硝酸与硫化物反应时,能将S2- 离子进一步氧化成SO42-离子。
3CdS + 8HNO3(稀) ===3Cd (NO3)2+ 2NO↑+ 4H2O + 3S↓
PbS + 8HNO3(浓) ===PbSO4 + 8NO2↑+ 4H2O
(2)稀硝酸只能把砷氧化成亚砷酸,而浓硝酸则进一步把亚砷酸氧化成砷酸。
As + HNO3(稀) + H2O ===H3AsO3+ NO↑
H3AsO3+ 2HNO3(浓) ===H3AsO4 + 2NO2↑+ H2O
(3)稀硝酸只能将氢碘酸氧化成单质碘,而浓硝酸则能把氢碘酸氧化成碘酸。
6HI + 2HNO3(稀) ===3I2+ 2NO↑+ 4H2O
HI + 6HNO3(浓) ===HIO3+ 6NO2↑+ 3H2O
(4)铂、金等贵金属不易被浓硝酸氧化,但1体积浓硝酸和3体积浓盐酸组成的混合物溶液(俗称王水)却能溶解铂和金。
Au + 4Cl-+ NO3-+ 4H+===[AuCl4]-+ NO↑+ 2H2O
3Pt+ 18Cl-+ 4NO3-+ 16H+===3[PtCl6]2-+ 4NO↑+ 8H2O
虽然铂、金不易被浓硝酸氧化,但当有Cl-离子存在时,和产物Au3+离子(或Pt4+离子)结合,生成了络离子[AuCl4]-(或[PtCl6]2-),从而降低了Au3+离子(或Pt4+离子)的浓度,金属就被继续氧化了。
(5)当硝酸与金属活动性顺序表中排在氢以前的活泼金属如镁、锌、铁等反应时,除可生成NO2或NO外,在更稀的硝酸中还可产生N2O、N2、NH3等。例如:
4Mg + 10HNO3(1 mol·L-1) === 4Mg (NO3)2 + NH4NO3+ 3H2O
4Mg + 10HNO3(2 mol·L-1) === 4Mg (NO3)2 + N2O↑+ 5H2O
3Mg + 8HNO3(6 mol·L-1) === 3Mg (NO3)2 + 2NO↑+ 4H2O
Mg + 4HNO3(16 mol·L-1) === Mg (NO3)2 + 2NO2↑+ 2H2O
可见,对于同一种还原剂来说,硝酸越稀被还原的程度越大。浓硝酸(12~16 mol·L-1)被还原的主要产物是NO2,稀硝酸(6~8 mol·L-1)被还原的产物主要是NO;再稀如2 mol·L-1的硝酸还原产物主要是N2O,而更稀的硝酸(1 mol·L-1)则被还原成NH3(NH3与HNO3反应生成NH4NO3)。
(6)铁、铝在冷的浓硝酸中发生钝化现象。
总之,硝酸的强氧化性来自硝酸根中的N元素,而不是硝酸电离出来的H+,这种氧化性的强弱还跟温度(温度越高氧化性越强)、酸度(如硝酸根在中性或弱酸性溶液中难以表现出氧化性,如硝酸亚铁中的Fe2+与NO3-可以稳定存在,但加盐酸时,Fe2+却被NO3-氧化成了Fe3+)等有关。物质氧化性的强弱是指氧化其它物质的能力,浓硝酸与铜反应比稀硝酸与铜反应剧烈的多,说明浓硝酸的氧化性比稀硝酸的氧化能力强。而不能从其本身被还原的程度大小来比较例如:
![]() 【例题】(2009年北京高考27题)某学习小组探究浓、稀硝酸氧化性的相对强弱,按下图装置进行试验(夹持仪器的装置已略去)。实验表明浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO。由此得出的结论是浓硝酸的氧化性强于稀硝酸。
【例题】(2009年北京高考27题)某学习小组探究浓、稀硝酸氧化性的相对强弱,按下图装置进行试验(夹持仪器的装置已略去)。实验表明浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO。由此得出的结论是浓硝酸的氧化性强于稀硝酸。
![]()
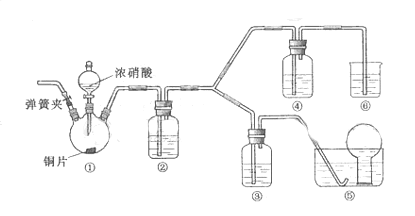
![]() 可选药品:浓硝酸、3mo/L稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳
可选药品:浓硝酸、3mo/L稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳
![]() 已知:氢氧化钠溶液不与NO反应,能与NO2反应
已知:氢氧化钠溶液不与NO反应,能与NO2反应
2NO2+ 2NaOH ===NaNO3+ NaNO2 + H2O![]()
![]() (1)实验应避免有害气体排放到空气中,装置③、④、⑥中盛放的药品依次是
(1)实验应避免有害气体排放到空气中,装置③、④、⑥中盛放的药品依次是
![]() (2)滴加浓硝酸之前的操作是检验装置的气密性,加入药品,打开弹簧夹后
(2)滴加浓硝酸之前的操作是检验装置的气密性,加入药品,打开弹簧夹后
![]() (3)装置①中发生反应的化学方程式是
(3)装置①中发生反应的化学方程式是
![]() (4)装置②的作用是 ,发生反应的化学方程式是
(4)装置②的作用是 ,发生反应的化学方程式是
![]() (5)该小组得出的结论以据的试验现象是
(5)该小组得出的结论以据的试验现象是
![]() (6)试验结束后,同学们发现装置①中溶液呈绿色,而不显蓝色。甲同学认为是该溶液中硝酸铜的质量分数较高所致,而乙同学认为是该溶液中溶解了生成的气体。同学们分别设计了以下4个试验来判断两种看法是否正确。这些方案中可行的是(选填序号字母)
(6)试验结束后,同学们发现装置①中溶液呈绿色,而不显蓝色。甲同学认为是该溶液中硝酸铜的质量分数较高所致,而乙同学认为是该溶液中溶解了生成的气体。同学们分别设计了以下4个试验来判断两种看法是否正确。这些方案中可行的是(选填序号字母)
![]() a.加热该绿色溶液,观察颜色变化
a.加热该绿色溶液,观察颜色变化
![]() b.加水稀释绿色溶液,观察颜色变化
b.加水稀释绿色溶液,观察颜色变化
![]() c.向该绿色溶液中通入氮气,观察颜色变化
c.向该绿色溶液中通入氮气,观察颜色变化
![]() d.向饱和硝酸铜溶液中通入浓硝酸与铜反应产生的气体,观察颜色变化
d.向饱和硝酸铜溶液中通入浓硝酸与铜反应产生的气体,观察颜色变化
![]() 【解析】本题主要考查HNO3的性质、化学基本实验设计和评价能力。(1)根据装置特点和实验目的,装置⑤是收集NO,装置⑥中盛放NaOH溶液吸收NO2,因为要验证稀HNO3不能氧化NO,所以装置③中应该盛放稀硝酸。
【解析】本题主要考查HNO3的性质、化学基本实验设计和评价能力。(1)根据装置特点和实验目的,装置⑤是收集NO,装置⑥中盛放NaOH溶液吸收NO2,因为要验证稀HNO3不能氧化NO,所以装置③中应该盛放稀硝酸。
![]() (2)由于装置中残存的空气能氧化NO而对实验产生干扰,所以滴加浓HNO3之前需要通入一段时间CO2赶走装置中的空气,同时也需将装置⑤中导管末端伸入倒置的烧瓶内防止反应产生的NO气体逸出。
(2)由于装置中残存的空气能氧化NO而对实验产生干扰,所以滴加浓HNO3之前需要通入一段时间CO2赶走装置中的空气,同时也需将装置⑤中导管末端伸入倒置的烧瓶内防止反应产生的NO气体逸出。
![]() (3)Cu与浓HNO3反应生成Cu(NO3)2、NO2、H2O:
(3)Cu与浓HNO3反应生成Cu(NO3)2、NO2、H2O:
Cu + 4HNO3(浓)=Cu(NO3)2+ 2NO2↑+2 H2O。
![]() (4)装置②中盛放H2O,使NO2与H2O反应生成NO:3NO2+ H2O ===2HNO3+ NO。
(4)装置②中盛放H2O,使NO2与H2O反应生成NO:3NO2+ H2O ===2HNO3+ NO。
![]() (5)NO通过稀HNO3溶液后,若无红棕色NO2产生,说明稀HNO3不能氧化NO,所以盛放稀HNO3装置的液面上方没有颜色变化即可说明之。装置④中盛放的是浓HNO3,若浓HNO3能氧化NO则装置④液面的上方会产生红棕色气体。
(5)NO通过稀HNO3溶液后,若无红棕色NO2产生,说明稀HNO3不能氧化NO,所以盛放稀HNO3装置的液面上方没有颜色变化即可说明之。装置④中盛放的是浓HNO3,若浓HNO3能氧化NO则装置④液面的上方会产生红棕色气体。
![]() (6)要证明是Cu(NO3)2浓度过高或是溶解了NO2导致装置①中溶液呈绿色,可设计将溶解的NO2赶走(a、c方案)再观察颜色变化。也可在Cu(NO3)2的浓溶液中通入NO2进行比较观察反应后的颜色变化(d方案),确定是否是因为溶有NO2引起的。方案b由于Cu(NO3)2和溶解在其中的NO2浓度均可发生变化,故无法确定是哪一种因素引起的。
(6)要证明是Cu(NO3)2浓度过高或是溶解了NO2导致装置①中溶液呈绿色,可设计将溶解的NO2赶走(a、c方案)再观察颜色变化。也可在Cu(NO3)2的浓溶液中通入NO2进行比较观察反应后的颜色变化(d方案),确定是否是因为溶有NO2引起的。方案b由于Cu(NO3)2和溶解在其中的NO2浓度均可发生变化,故无法确定是哪一种因素引起的。
![]() 答案
答案![]() :(1)3 mol/L稀硝酸、浓硝酸、氢氧化钠溶液
:(1)3 mol/L稀硝酸、浓硝酸、氢氧化钠溶液
![]()
![]() (2)通入CO2一段时间,关闭弹簧夹,将装置⑤中导管末端伸入倒置的烧瓶内
(2)通入CO2一段时间,关闭弹簧夹,将装置⑤中导管末端伸入倒置的烧瓶内
![]()
![]() (3)Cu + 4HNO3(浓)===Cu(NO3)2+ 2NO2↑ + 2H2O
(3)Cu + 4HNO3(浓)===Cu(NO3)2+ 2NO2↑ + 2H2O
![]()
![]() (4)将NO2转化为NO 3NO2 + H2O ===2HNO3 + NO
(4)将NO2转化为NO 3NO2 + H2O ===2HNO3 + NO
![]()
![]() (5)装置③中液面上方气体仍为无色,装置④中液面上方气体由无色变为红棕色
(5)装置③中液面上方气体仍为无色,装置④中液面上方气体由无色变为红棕色
![]()
![]() (6)a c d
(6)a c d
【练习1】在100 mL浓HNO3中,加入足量的铜片产生a L气体,用排水法收集后得到b L气体(气体的体积都是在标准状况下测定的),则原浓硝酸的物质的量浓度是多少?
解析:依题意,a L气体是NO2和NO的混合气体,b L气体全为NO气体。该题若根据化学方程式列式计算就显得很复杂,我们可作如下分析:起氧化剂作用的HNO3的物质的量=b/22.4 ,根据电子守恒,Cu所失去的电子的物质的量恰好为HNO3生成b L NO气体时所得电子的物质的量,即Cu失电子=(b/22.4)×3,反应的Cu的物质的量=3/2×b/22.4 mol。则起酸性作用的HNO3为3/2×b/22.4 mol×2 =3b/22.4 mol,所以HNO3的物质的量为b/22.4mol + 3b/22.4mol = b/5.6mol,浓度为25b/14 mol·L-1.
答案:25b/14mol·L-1
点拨:铜与浓硝酸的反应要考虑反应过程中硝酸浓度的变化,开始生成NO2,后来生成NO,最后得到的是NO2和NO的混合物。类似这样的反应还有:①锌与浓硫酸的反应,开始生成SO2,随着反应的不断进行,浓硫酸变稀,反应产物还有H2;②足量的二氧化锰和浓盐酸共热,开始生成Cl2,随着反应的不断进行,浓盐酸变稀,产生的Cl2越来越少,虽然还有HCl,由于浓度变小,反应不再进行。
【练习2】在铁与铜的混合物中,加入一定量的稀HNO3,充分反应后剩余金属m1g,,再向其中加入一定量的稀H2SO4充分振荡后,剩余金属m2g,则m1和m2的关系是
A. m1一定大于m2 B. m1可能等于m2 C. m1一定等于m2 D. m1可能大于m2
解析:铁与铜的混合物与一定量的稀HNO3反应,当金属剩余时,硝酸耗尽,但生成物中含有Fe(NO3)2和Cu(NO3)2。若再加入稀H2SO4,则又继续发生3Cu + 8H++ 2NO3-===3Cu2++ 2NO↑+ 4H2O或Fe + 4H++ NO3-===Fe3++ NO↑+ 2H2O,使金属的质量减少。A选项符合题意。
答案:A
点拨:解答该题要注意,剩余的金属成分不可能只有铁,因为Fe + Cu2+===Fe2+ + Cu。当剩余金属只有铜时,加稀H2SO4,认为Cu与稀H2SO4不反应,若为Fe、Cu混合物时,Fe溶解,而错选B、D,因为这样是忽略了NO3-在酸性条件下具有强氧化性的缘故。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。一、拟卤素 1、涵义 某些原子团形成的分子,与卤素单质分子的性质相似,它们的阴离子...
一、 心概念与知识网络 “反应历程”或“反应机理”是近年来高考化学的热点。它不再是...
一、硫和金单质的反应 据我国古代第一部药物学专著《神农本草经》记载:“石硫黄(即硫...
高价态的含氧酸酸性强于低价态含氧酸的酸性,那么氧化性呢?比如,亚硝酸的氧化性就强...
...
浓硫酸和浓硝酸都具有氧化性,那么它俩谁更强呢?首先,必须确保同浓度下,水溶剂体系...