
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、问题来源
2023年浙江6月选考T9
D.向硫化钠溶液通入足量二氧化硫:
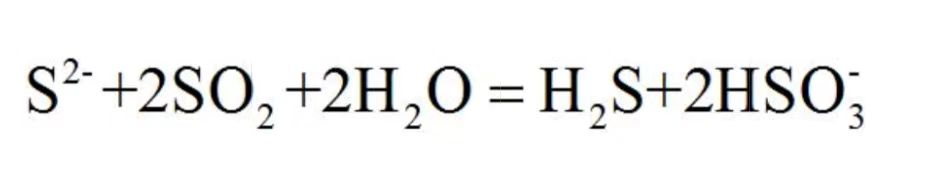
因为硫离子和二氧化硫在酸性条件下会发生归中,生成S,所以肯定错了。
那么当通入过量二氧化硫时,正确的离子方程式是什么呢?如果通入少量二氧化硫时,方程式又应该是什么?
二、反应历程及化学方程式
以1 L 0.1 mol/L Na2S溶液中通入SO2为例
注:1-3都是SO2未过量时的反应,只有4是SO2过量
1、首先,SO2通入Na2S溶液中,SO2首先和水反应生成H2SO3。
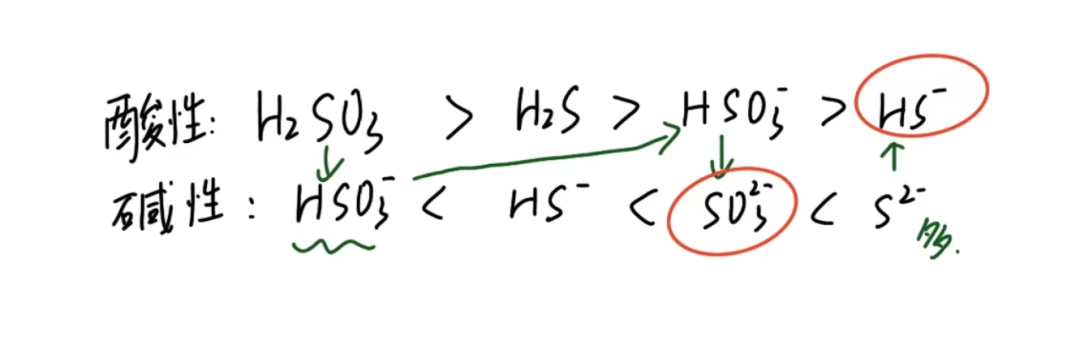
根据化学人教版附录:
Ka(H2SO3) =1 .4×10⁻²
Ka(HsO3-) = 6.0×10⁻⁸
Ka(H2S) = 1.1×10⁻⁷
Ka(Hs⁻) = 1.3×10⁻¹³
得:H2SO3> H2S > HSO3-> HS⁻
故第一步反应,当二氧化硫通入一点点,应该生成Na2SO3和HS⁻
SO2+H2O + 2S²⁻ = SO32-+ 2HS⁻
2、随着SO2通入量的增加(但仍小于0.1 mol),体系pH逐渐下降,生成NaHSO3和H2S,但是陈克志[1]指出主要反应是:
SO2+H2O + 2S²⁻ = HSO3-+ 2HS⁻
3、当pH降至低于7.5时(这时SO2达到0.1 mol),才发生氧化还原反应并生成S:
3SO2+2S²⁻ = 2SO32-+ 3S↓
4、继续通入SO2至过量,生成S的同时Na2SO3转化为NaHSO3(Na2SO3和SO2反应,可类比成Na2CO3溶液通入过量CO2反应生成NaHCO3):
5SO2+2S²⁻ + 2H2O = 4HSO3-+ 3S↓
参考资料
[1]陈克志.对Na2S溶液中通SO2反应的探讨[J].中学化学教学参考,2016,(Z1):54-56.
[2]董顺. SO2与Na2S溶液反应的理论分析[J]. 化学教学,2012(12):76-77.

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。二氧化硫与硫化钠溶液反应时,根据反应条件特别是二氧化硫的量的不同,可能产生不同的...
1、问题来源 2023年浙江6月选考T9 D.向硫化钠溶液通入足量二氧化硫: 因为硫离子和二...
...
浓硫酸与稀硫酸的分界线 我们所说的具有典型吸水性、脱水性和强氧化性的浓硫酸,指的...
稀硝酸比 浓硝酸 更稳定,不能够简单的理解浓度因素,实际上硝酸浓度越高,越不稳定,...
HSCN有硫氰酸(H - S - C ≡ N)和异硫氰酸(H - N = C = S)两种结构;但硫氰酸结构...