
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
液体气化时除了破坏分子间作用力外,还必须破坏分子间氢键,需要消耗更多的能量。计算表明,氢键的键能要占水分子之间的分子间作用力总量的5/6。H2O和HF的熔点、沸点异常地高,就是由于这些分子间存在着氢键的缘故。
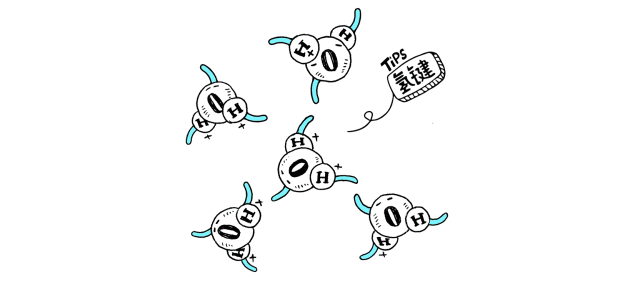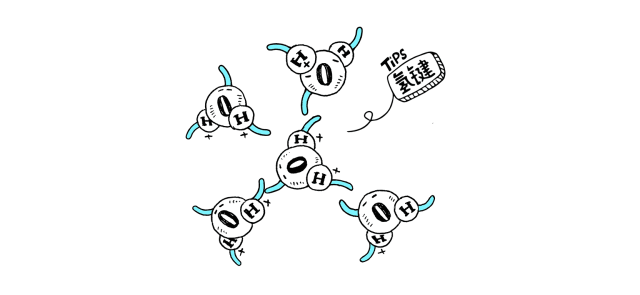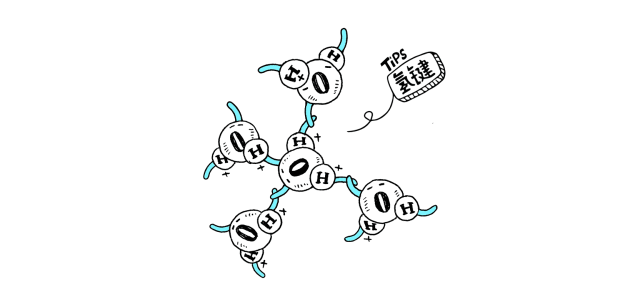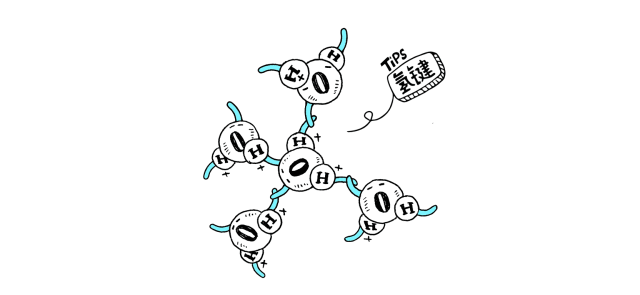
物质分子间若形成氢键,有可能发生缔合现象。液态HF在通常条件下,除了单个HF分子外,还有通过氢键相连而成的缔合分子(HF)n,n可以是2,3,4,……。H2O分子之间也有缔合现象,形成(H2O)n。而水蒸气中水以单个的H2O分子形式存在;红外及电子衍射等研究表明气态HF是单体HF和环状六聚体(HF)6的平衡混合物,在一定的温度和压力下也可能存在链状二聚体(HF)2。
由于这些因素的影响,虽然就单个氢键来说,键能F—H…F大于O—H…O,但就固态变成液态或液态变成气态所需消耗的能量来说,H2O却大于HF;H2O的熔点、沸点要比HF高:
(1)液态HF分子中,每摩尔HF分子只分享到一摩尔氢键;而在液态水中,每摩尔H2O中有两摩尔氢键。等物质量的水形成氢键的总数比液态HF来得多。

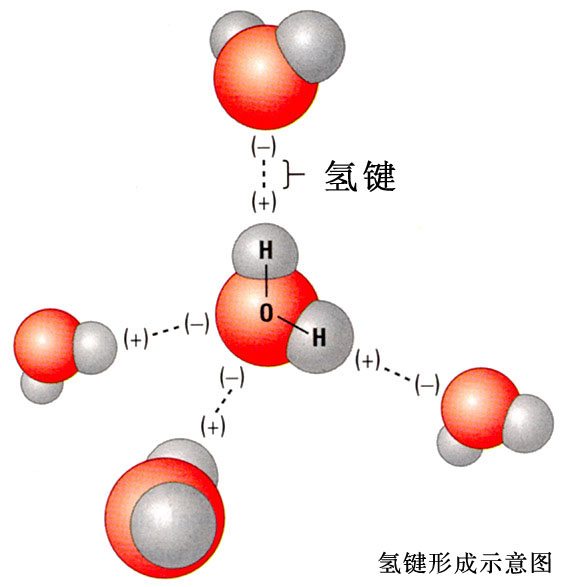
(2)液态HF汽化不需要破坏所有的氢键,而只需破坏其中的一部分,而水汽化要破坏所有的氢键。有关数据表明,冰中氢键的作用能为18.8kJ•mol-1,而冰的熔化热只有5.0 kJ•mol-1。即使冰的熔化热全部用于破坏冰的氢键而无他用,在0℃时冰熔化成液态水,至多只能打破冰中全部氢键的约13%[等于5/(18.8×2)]。这就意味着,刚刚熔化的水中仍存在着许多由氢键作用而形成的小集团(H2O)n。随着温度升高,水中的氢键逐渐断裂。但在沸点时液态水中依然存在相当数量的氢键,这可由373K时水的蒸发热为40.63kJ•mol-1得以证实。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。通常而言,同主族元素形成的X-X键,自上而下,键长逐渐增大,键能逐渐降低。 根据元素...
无机化学实验是一门与无机化学理论课密切配合的课程。实验用化学事实充实了理论课的学...
能否形成氢键的“视点”:一看有无电负性...
1mol 氨中氢键数量分析 一、氢键形成机制 NH分子结构 H原子作为氢键供体(需与高电负性...
二氧化氮(NO)中氮原子的杂化类型为 sp杂化,具体分析如下: 1.计算 n (的价层电子对数...
...