
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
1.为什么HF分子间氢键比H2O分子间氢键强,而HF的沸点却比H2O的低?
由于氟原子半径比氧原子小,电负性大于氧,所以HF分子间的F-H…F氢键比H2O分子间的O—H…O氢键要强得多,前者键能为28kJ/mol,后者18.8kJ/mol。即使在气态时,HF分子间的氢键尚未完全破坏,还有许多是以缔合分子(HF)2存在;而水分子在水蒸气中氢键已不能起很大作用,即大部分以单个分子存在,仅有约3.5%的双分子水(H2O)2存在。但是,水的沸点却比氟化氢的高。这是因为一个水分子可以形成两个氢键,而每个氟化氢分子只能形成一个氢键,因而要使氢键完全断裂成为气体分子所需要的总能量就比使HF分子间氢键断裂所需的要多,再加上液态氟化氢气化时氢键还有不完全断裂的因素,所以水气化时所需要能量要多,因而温度要高。
2.氨分子与水分子形成的氢键可表示为

究竟哪一种正确?
从理论上分析:若形成的氢键越强,则体系能量越低,物质越稳定。由于氧原子半径比氮原子小,氧元素电负性比氮元素大,所以H-O键中,共用电子对偏向于氧原子的程度与N-H键中共同电子对偏向氮原子的程度比较,H-O键程度大,所以H-O键中的氢原子更接近于“裸露的质子”。对于孤电子对的电子云,有更强的吸引力,所以NH3分子中N原子的一对孤电子对比H2O分子中O原子的孤电子对更易允许几乎裸露的质子“钻入”电子云。所以,N…H-O氢键比N-H…O氢键更为牢固,因而(Ⅱ)正确。
从实验事实上分析:水溶液中在水分子的作用下,使极性共价键转化为离子键,氢原子完全转化为氢离子,从而使形成氢键的孤对电子完全进入H+离子的空轨道,成为配位键。这样,根据两种结构式就会发生如下两种可能的转化:
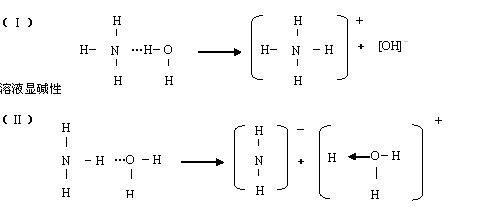
实验事实证明,氨水是呈碱性的,即按(Ⅰ)转化。
从理论和实验事实两方面分析都得出一个共同结论,即氨分子与水分子间形成的氢键,表示为:
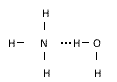

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。人教版高中化学必修第一册2019年6月第1版2024年7月第8次印刷P 10 3 讲解卤素单质与氢...
冰在0℃开始融化。这是本家都熟悉的事儿。 然而,世界上竟有热冰它在3.8℃方才融化! ...
1. 为什么 HF 分子间氢键比 H 2 O 分子间氢键强,而 HF 的沸点却比 H 2 O 的低? 由于...
1、为什么氧、氟没有最高正价?(朱朝宇) 氟是非金属性最强的元素,理论上没有哪种物...
1.如何理解分子间作用力的本质也是静电作用? 首先,在极性分子与极性分子之间,存在...
【关于化学键(Chemical bond)】: 化学键(Chemical bond)实质上是电性的微观作用...