
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
在最近几年全国卷高考化学试题的物质结构与性质选做题中,经常涉及到大π键的考查。例如:2017年全国卷II分子中的大π键可用符号表示,其中m代表参与形成的大π键原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示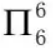 ),则N5-中的大π键应表示为(答案为
),则N5-中的大π键应表示为(答案为![]() )。2017年全国卷III硝酸锰是制备上述反应催化剂的原料,Mn(NO3)2中的化学键除了σ键外,还存在(答案为离子键和π键)。高考化学考试大纲对该处知识点的要求为“了解共价键的形成、极性、类型(σ键和π键)”。2017年全国II卷在该题题干中给出了大π键的信息,相对来说答案比较容易给出,但2017年全国卷III学生作答时该处答案很难给全。
)。2017年全国卷III硝酸锰是制备上述反应催化剂的原料,Mn(NO3)2中的化学键除了σ键外,还存在(答案为离子键和π键)。高考化学考试大纲对该处知识点的要求为“了解共价键的形成、极性、类型(σ键和π键)”。2017年全国II卷在该题题干中给出了大π键的信息,相对来说答案比较容易给出,但2017年全国卷III学生作答时该处答案很难给全。
物质结构部分为选考内容,部分高中学校因某些原因未予讲解该部分内容。高考大纲中对该处知识点的要求为“了解共价键的形成、极性、类型(σ键和π键)”。对于一般学校,该处考点的教学以了解π键是轨道肩并肩重叠而成,以N2为例,只需要了解n(的)P轨道肩并肩重叠形成π键,N2分子中形成了1个σ键和2个π键即可。而对于大π键的形成基本未予介绍,直接结果就是2017年全国卷III中的该空很难得满分。
针对大π键的课堂教学,应放在高三一轮复习中,建议采取以下模式:
一、π键的概念及普通π键形成
以N2的成键特点为例复习π键的概念,并让学生板演N2中的π键如何形成。进而总结出以下结论:原子轨道以“肩并肩”方式相互重叠导致电子在核间出现的概率增大,即电子云重叠后得到的电子云图像呈镜像对称,这样形成的共价键叫做π键,形成π键的电子叫π电子。
二、乙烯中π键形成
如果同学们对N2的成键特点掌握较好,可将知识延伸至乙烯中的π键的形成。引导学生从杂化角度先考察分子的空间构型,有机物的杂化可从碳原子的成键特点判断,乙烯中碳碳之间靠双键连接,因此碳原子为sp2杂化,分子共平面,碳碳双键中包括1个σ键和1个π键,碳原子中未参与杂化的p轨道垂直于分子平面,各填充一个电子,形成普通的π键。
三、常见微粒的大π键问题
以2017年全国卷III的高考真题入手,让学生填写Mn(NO3)2中的化学键除了σ键外,还存在。由于前期教学未提及大π键的问题,该处答案很难答全。以此入手提出大π键问题。
微粒的杂化方式是研究大π键的形成的知识储备,如果是ABn型微粒可用价层电子对互斥理论(VSEPR)方法解决,本文不对VSEPR方法进行过多介绍。
以高中常见的一些微粒为例,详细介绍大π键的表示方法。
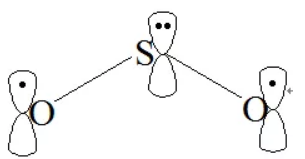
1. SO2中的大π键
由价层电子对互斥理论可以看出中心硫原子为sp2杂化,则SO2三个组成原子共面。一般端原子不考虑杂化的问题,但在大π键的形成过程中,端原子一般采用与中心原子相同的杂化方式,则在SO2中氧原子也为sp2杂化。硫原子的2个sp2杂化轨道与氧原子的sp2杂化轨道组成2个普通的σ键,硫原子剩余的1个sp2杂化轨道被孤对电子占据,氧原子剩余的2个sp2杂化轨道被孤对电子占据。硫原子未参与杂化的p轨道填充2个电子且垂直于分子平面,氧原子剩余的未参与杂化的P轨道填充1个电子且垂直于分子平面,具备了形成大π键的所有条件,因此SO2中的大π键可表示为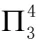 。由于O3与SO2互为等电子体,因此O3体系中也存在的大π键。
。由于O3与SO2互为等电子体,因此O3体系中也存在的大π键。
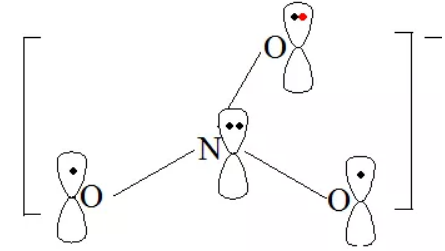
2. NO3-中的大π键
由价层电子对互斥理论可以看出中心氮原子为sp2杂化,氧原子作为端原子也采用sp2杂化,则NO3-四个组成原子共面;氮原子的3个sp2杂化轨道各填充1个电子与氧原子的sp2杂化轨道组成3个σ键,剩余的1个未参与杂化的P轨道被孤对电子占据且垂直于该平面。3个氧原子均采用相同的模式,即2个sp2杂化轨道被孤对电子占据,剩余的未参与杂化的P轨道填充1个电子且垂直于该平面。并且该体系带有1个单位负电荷,具备了形成大π键的条件,因此NO3-中的大π键可表示为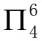 。SO3、CO32-与NO3-互为等电子体,也具有的大π键。
。SO3、CO32-与NO3-互为等电子体,也具有的大π键。
3.苯中的大π键
苯中的6个碳原子均采取sp2杂化方式,每个碳原子用1个sp2杂化轨道与氢原子形成σ键,用2个sp2杂化轨道与其他2个碳原子的sp2杂化轨道形成σ键,未参与杂化的p轨道上填充1个电子且垂直于分子平面,具备了形成大π键的条件,因此苯分子中的大π键可表示为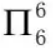 。石墨的成键方式与苯类似,石墨中也存在大π键可表示为
。石墨的成键方式与苯类似,石墨中也存在大π键可表示为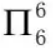 。
。
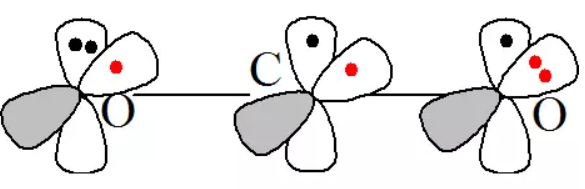
4. CO2中的大π键
CO2为直线型分子,其中的中心碳原子为sp杂化,氧原子也采用相同的sp杂化方式。碳原子利用2个sp杂化轨道与氧原子的sp杂化轨道形成σ键,氧原子的另一个sp杂化轨道被孤对电子占据,则氧原子未参与杂化的轨道分别填充1个及2个电子。碳原子未参与杂化的P轨道互相垂直均填充1个电子,且均垂直于CO2组成的直线。氧原子未参与杂化的2个轨道互相垂直,且均垂直于CO2组成的直线。在一个方向上,碳原子的1个p轨道与2氧原子的p轨道形成大π键,可表示为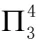 。在另一个方向上也形成的大π键。因此CO2分子中含2个大π键,均为
。在另一个方向上也形成的大π键。因此CO2分子中含2个大π键,均为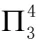 。可能有的同学在书写时写出了1个π33和1个π35,但该情况没有2个
。可能有的同学在书写时写出了1个π33和1个π35,但该情况没有2个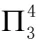 稳定,原因在大学无机化学教材中将予以介绍,本文不再赘述
稳定,原因在大学无机化学教材中将予以介绍,本文不再赘述
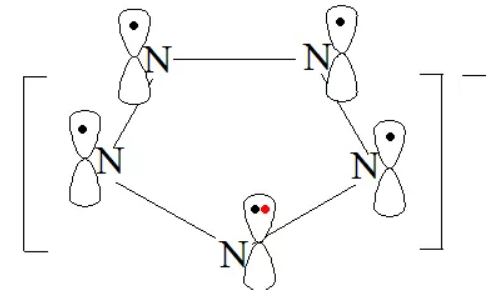
5. N5-中的大π键
我们再来看2017全国II卷中的N5-中的大π键。微粒为共平面形式,5个N原子均采取sp2杂化方式。每个氮原子利用2个sp2杂化轨道与其他的N原子的sp2杂化轨道形成σ键,剩余的1个sp2杂化轨道被孤电子对占据,则未参与杂化的p轨道填充1个电子且垂直于该平面,并且该微粒带有1个单位负电荷,因此形成的大π键可表示为![]() 。
。
四、大π键的形成条件及一般规律
如果第三部分所举微粒的大π键问题学生能全部掌握,就会很轻松的总结出大π键的形成条件。课堂上应重点强调总结的是大π键的形成条件,即微粒必须是共平面结构,也就是中心原子应采取sp2或sp杂化形式,中心原子若为sp3杂化则不能形成大π键。
形成大π键的条件为多个原子共平面、原子都提供平行的轨道、提供的电子总数小于轨道数的2倍。同时我们也可以利用等电子体的原理将问题迁移,互为等电子体的微粒具有相同的成键方式,因此掌握好常见物质的大π键问题可解决很多微粒的成键方式。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。通常而言,同主族元素形成的X-X键,自上而下,键长逐渐增大,键能逐渐降低。 根据元素...
无机化学实验是一门与无机化学理论课密切配合的课程。实验用化学事实充实了理论课的学...
能否形成氢键的“视点”:一看有无电负性...
1mol 氨中氢键数量分析 一、氢键形成机制 NH分子结构 H原子作为氢键供体(需与高电负性...
二氧化氮(NO)中氮原子的杂化类型为 sp杂化,具体分析如下: 1.计算 n (的价层电子对数...
...