
|
学习小专题 |

|
学习小专题 |
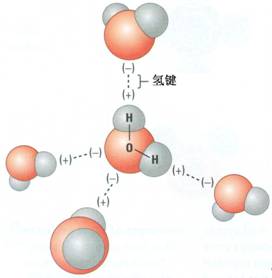 [方法与规律j] 盐溶液中离子浓度关系分析的常见切入点 作者:孙远征 来源: 日期:2008-07-11 04:11:29 点击:6676 所属专题:离子浓度大小比较
[方法与规律j] 盐溶液中离子浓度关系分析的常见切入点 作者:孙远征 来源: 日期:2008-07-11 04:11:29 点击:6676 所属专题:离子浓度大小比较
除醋酸铅、氯化亚汞等少数盐是弱电解质外,大多数盐是强电解质,在溶液中能完全电离,不存在溶质分子,但盐的离子可能会发生水解反应,盐的水解反应一般是可逆的,存在水解平衡,其中弱酸的酸式酸根离子还存在电离平衡,溶液中,溶剂水也存在电离平衡。 首先必须明确溶...
 [方法与规律j] 正确书写盐类水解的离子方程式 作者:董啸 来源: 日期:2008-07-11 03:56:42 点击:12071 所属专题:盐类水解方程式
[方法与规律j] 正确书写盐类水解的离子方程式 作者:董啸 来源: 日期:2008-07-11 03:56:42 点击:12071 所属专题:盐类水解方程式
盐类水解属于离子反应,可以按照离子方程式的书写规范,写出正确的离子方程式。例如,硫酸铜水解的离子方程式可按以下三个步骤写出: 第一步 写出 水解的化学方程式 第二步 把易溶于水的强电解质改写为离子形式 第三步 消去反应式两边相同的离子( ) 上述这个盐类水解...
 [方法与规律j] 弱电解质判断技巧透析 作者:陈螯 来源: 日期:2022-02-22 14:54:13 点击:14161 所属专题:弱酸实验判断
[方法与规律j] 弱电解质判断技巧透析 作者:陈螯 来源: 日期:2022-02-22 14:54:13 点击:14161 所属专题:弱酸实验判断
弱电解质的判定是电解质溶液部分的重要内容,也是历年来高考的热点。在近年的高考中主要以选择题为主,有时也出现在主观性试题中(考查操作的科学性和可行性及对所给化学实验设计给予评价),因而掌握其判定的思维角度和方法是十分重要的。现以醋酸为例进行分析。 一、...
 [方法与规律j] 溶液pH计算方法归纳 作者:曹启凤 来源: 日期:2016-02-02 19:44:28 点击:33337 所属专题:ph计算
[方法与规律j] 溶液pH计算方法归纳 作者:曹启凤 来源: 日期:2016-02-02 19:44:28 点击:33337 所属专题:ph计算
PH计算问题是近几年高考的热点问题,为帮助同学们全面的掌握这方面的问题,现对此进行归纳。溶液PH计算的整体思路是:根据PH的定义PH=-lgc(H + ),溶液PH计算的核心是确定溶液中的c(H + )相对大...
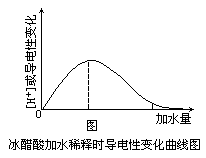 [方法与规律j] 怎样判断电解质的强弱 作者:刘明 来源: 日期:2016-02-02 21:34:15 点击:17881 所属专题:弱电解质判断
[方法与规律j] 怎样判断电解质的强弱 作者:刘明 来源: 日期:2016-02-02 21:34:15 点击:17881 所属专题:弱电解质判断
溶解于水或熔融状态下能导电的化合物是电解质。此定义可以分解为三要素:①熔化或者溶解。②能导电。③化合物。但在判断电解质的强弱时,没有明确指出具有极性键的共价化合物,哪些是强电解质,哪些是弱电解质。究竟强弱电解质有哪些判断依据呢? 一般来讲强弱电解质可...
 [方法与规律j] 酸碱中和定量考查四方式 作者:李文才 来源: 日期:2016-02-02 21:37:05 点击:13858 所属专题:酸碱中和
[方法与规律j] 酸碱中和定量考查四方式 作者:李文才 来源: 日期:2016-02-02 21:37:05 点击:13858 所属专题:酸碱中和
近几年高考,几乎都有以酸+碱盐+水这一中和反应情景为铺垫,将酸碱的电离、电离度、盐的水解、pH计算、电解质溶液中微粒的物料守恒、电荷守恒等知识串联起来进行定量考查的题目,尤以2000年全国卷第26题考查的力度最大,设问从思维能力的层次要求由低到高逐步加深,...
 [方法与规律j] 常见水解反应 作者:段毕君 来源: 日期:2016-02-02 21:39:46 点击:38831 所属专题:水解反应
[方法与规律j] 常见水解反应 作者:段毕君 来源: 日期:2016-02-02 21:39:46 点击:38831 所属专题:水解反应
一.简单水解反应 水解物质 水解化学方程式 水解离子方程式 1. 硫化钠水解 Na 2 S+H 2 O NaHS+NaOH S 2- +H 2 O HS - +OH - 2. 碳酸钠溶液呈碱性的原因 Na 2 CO 3 +H 2 O NaHCO 3 +NaOH CO 3 2 - + H 2 O HCO 3 - + OH - 3.AlCl 3 溶液显酸性的原因 AlCl 3 +3H 2 O...
 [方法与规律j] 溶液中电中性的应用 作者:李萱 来源: 日期:2016-02-02 21:43:56 点击:15169 所属专题:电荷守恒
[方法与规律j] 溶液中电中性的应用 作者:李萱 来源: 日期:2016-02-02 21:43:56 点击:15169 所属专题:电荷守恒
无论是单一液质的溶液 , 还是混合溶液;无论是稀溶液 , 还是浓溶液 , 其电解质溶液一定呈电中性 , 这是电解质溶液的一个基本性质。如果能善于利于这一性质 , 对解决一些溶液中的问题会带来很大的帮助 , 现举几例说明 : 1. 进行溶液中离子浓度的比较 例 1 . 常温下氨水...
 [方法与规律j] 两溶液相混后pH判断 作者:何永成 来源: 日期:2016-02-02 19:34:08 点击:16526 所属专题:酸碱中和 酸碱性判断
[方法与规律j] 两溶液相混后pH判断 作者:何永成 来源: 日期:2016-02-02 19:34:08 点击:16526 所属专题:酸碱中和 酸碱性判断
题目: 常温下, pH=2 的 溶液与 pH=12 的 NaOH 溶液等体积混合(设混合液总体积为两溶液体积之和,下同)后,溶液的 pH 为( );常温下, 0.01mol/L 的 溶液与 0.01mol/L 的 NaOH 溶液等体积混合后,溶液的 pH 为( ) A. pH7 B. pH7 C. pH=7 D. 无法确定 解析: 常...
 [方法与规律j] 离子浓度比较中要处理好的三个关系 作者:罗云峰 来源: 日期:2007-06-12 13:44:31 点击:9760 所属专题:离子浓度大小比较
[方法与规律j] 离子浓度比较中要处理好的三个关系 作者:罗云峰 来源: 日期:2007-06-12 13:44:31 点击:9760 所属专题:离子浓度大小比较
离子浓度大小的比较是电解质溶液部分的重要知识点,是困扰学生学好电解质理论的一大难关。对此,教师在授课时除应尽可能多列举数据使学生理解弱电解质的电离程度大小和盐类水解程度的大小外,还应对各种浓度大小比较加以总结归纳,使之系统化、条理化,为学生用好这些...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。弱酸也可以制备强酸!!! 比如向 CuSO 4 溶液中加入 H 2 S 溶液生成 CuS 黑色沉淀和 ...
氧化还原滴定法: 1.特点: 氧化还原滴定法在药物分析中应用广泛,用于测定具有氧化性...
问题1: 在酸溶液中,H + 和OH - 的来源分别是什么?举例说明怎样计算由水电离产生...
电离平衡常数是高考中一个重要的必考考点,常考查电离平衡常数的计算、弱酸的相对强弱...
...
一、原理:影响水的电离平衡因素 H 2 O H + +OH - 1.25 ℃, → c (H + ) H2O = ...
...
电解质溶液中有关离子浓度的判断是近年化学高考的重要题型之一。解此类型题的关键是掌...