
|
学习小专题 |

|
学习小专题 |
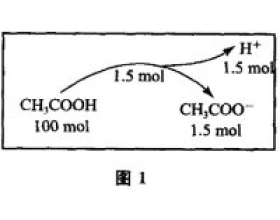 [方法与规律j] 基于模型思想的离子浓度大小比较 作者:邬兆宇 来源:未知 日期:2014-11-24 11:06:28 点击:13515 所属专题:离子浓度大小比较
[方法与规律j] 基于模型思想的离子浓度大小比较 作者:邬兆宇 来源:未知 日期:2014-11-24 11:06:28 点击:13515 所属专题:离子浓度大小比较
人的认识是从感性的直观开始到理性的抽象才能反映客观事物本质的规律性。要反映事物本质的规律性,认识必须超出感性的直观世界,形成相对独立的主观精神世界。这种超越要依靠一种抽象化的能够分开主体与客体的中介物,这个中介物就是模型。在通常情况下,模型分为物质模...
 [方法与规律j] 盐类水解的应用规律 作者:邬兆宇 来源:未知 日期:2013-03-11 10:36:19 点击:5362 所属专题:盐类水解应用
[方法与规律j] 盐类水解的应用规律 作者:邬兆宇 来源:未知 日期:2013-03-11 10:36:19 点击:5362 所属专题:盐类水解应用
盐的离子跟水电离出来的氢离子或氢氧根离子生成弱电解质的反应,称为盐类的水解。 其一般规律是:谁弱谁水解,谁强显谁性;两强不水解,两弱更水解,越弱越水解。 哪么在哪些情况下考虑盐的水解呢? 1.分析判断盐溶液酸碱性时要考虑水解。 2.确定盐溶液中的离子种类和浓度时要考虑...
 [方法与规律j] 由水电离出的氢离子浓度大小与溶液的pH关系的讨论 作者:袁建标 来源:未知 日期:2018-07-19 16:53:56 点击:52675 所属专题:水电离氢离子浓度
[方法与规律j] 由水电离出的氢离子浓度大小与溶液的pH关系的讨论 作者:袁建标 来源:未知 日期:2018-07-19 16:53:56 点击:52675 所属专题:水电离氢离子浓度
怎样理解“由水电离出的氢离子浓度=10 -a mol/L”,这句话能够推出什么,是令许多同学困惑的问题。我认为,主要原因是这是一个逆向思维的问题。由于思维所需要的知识不清楚,所以导致了思维混乱。为了解决这一难题,本文拟做以下尝试。 为了能够解决本文题目提出的问题,...
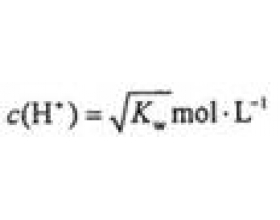 [方法与规律j] 酸碱溶液等体积混合后溶液pH的定性分析专题 作者:胡嘉谋 来源:未知 日期:2018-11-28 10:19:38 点击:14999 所属专题:酸碱中和 酸碱性判断
[方法与规律j] 酸碱溶液等体积混合后溶液pH的定性分析专题 作者:胡嘉谋 来源:未知 日期:2018-11-28 10:19:38 点击:14999 所属专题:酸碱中和 酸碱性判断
【问题】 室温时,下列溶液等体积混合后,溶液pH是大于7、小于7、等于7、还是无法判断? ①0.1 mol·L - 1 的盐酸溶液和pH=13的氢氧化钡溶液 ②0.1 mol·L - 1 的硫酸溶液和pH=13的氢氧化钠溶液 ③pH=1的盐酸溶液和0.1 mol·L - 1 的氨水溶液 ④pH=1的硫酸和0.1mol·L -...
 [方法与规律j] 溶液混合与pH判断分析 作者:方丽妹 来源:未知 日期:2016-02-02 19:52:30 点击:9417 所属专题:酸碱中和 酸碱性判断
[方法与规律j] 溶液混合与pH判断分析 作者:方丽妹 来源:未知 日期:2016-02-02 19:52:30 点击:9417 所属专题:酸碱中和 酸碱性判断
溶液混合后,溶液整体的PH如何计算?如何快速判断混合溶液的酸碱性? 教学过程中经常听说:等浓度等体积混合,谁强显谁性;等体积PH之和为14,谁弱显谁性。当然这样的判断方法绝大多数情况下没有大问题,但是细究起来,这种简单的技巧很容易造成判断的失误。 先分析一下...
 [方法与规律j] 盐类水解在解题中的运用 作者:陈博殷 来源:未知 日期:2012-10-24 17:25:23 点击:16603 所属专题:盐类水解应用
[方法与规律j] 盐类水解在解题中的运用 作者:陈博殷 来源:未知 日期:2012-10-24 17:25:23 点击:16603 所属专题:盐类水解应用
一、下列情况要考虑盐类的水解 1. 配制某些盐溶液 [ 例 1] 如何配制澄清透明的 SnCl 2 、 FeCl 3 、 CuSO 4 、 AgNO 3 、 FeSO 4 等溶液? [ 分析 ] 上述盐都能水解,有少量难溶的物质生成,溶液往往浑浊。配制时,应将这些固体溶解在对应的酸里,以抑制水解。如配制 FeSO 4...
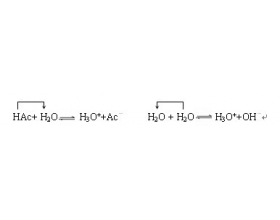 [方法与规律j] 质子平衡式的三种推导方法 作者:刘心宇 来源:未知 日期:2014-03-20 10:43:20 点击:28931 所属专题:质子守恒
[方法与规律j] 质子平衡式的三种推导方法 作者:刘心宇 来源:未知 日期:2014-03-20 10:43:20 点击:28931 所属专题:质子守恒
质子平衡式是用物质的量浓度表示得失质子(指氢离子)数相等的方程式。其书写方法有很多,现 有 以下几种比较简便的方法 : 1. 关系式法 关系式法的使用关键是找出溶液中各物质之间的平衡关系,并依据平衡条件,即 碱得到的质子总数 == 酸放出的质子总数 如:醋酸溶液中...
 [方法与规律j] 剖析电解质溶液中微粒关系 作者:陈桂芳 来源:未知 日期:2016-02-02 20:01:27 点击:20621 所属专题:离子浓度大小比较
[方法与规律j] 剖析电解质溶液中微粒关系 作者:陈桂芳 来源:未知 日期:2016-02-02 20:01:27 点击:20621 所属专题:离子浓度大小比较
电解质溶液属于混合体系。因电解质溶液能够发生电离、水解等反应,使得溶液中存在着多种形式的微粒,微粒的浓度也因此而变化。下面是笔者的一些探讨,供参考。 一、守恒关系 (1)电荷守恒:电解质溶液中阳离子所带的正电荷总数等于阴离子所带的负电荷总数。值得注意的...
 [方法与规律j] 一元强酸与一元弱酸比较的几种方法 作者:邵磊 来源:未知 日期:2012-09-22 20:10:10 点击:17647 所属专题:强酸与弱酸比较
[方法与规律j] 一元强酸与一元弱酸比较的几种方法 作者:邵磊 来源:未知 日期:2012-09-22 20:10:10 点击:17647 所属专题:强酸与弱酸比较
在中学化学电解质溶液一章的学习中,常常需要根据一元强酸与一元弱酸的一些性质进行有关的判断和推断。一元强酸与一元弱酸(或一元强碱与一元弱碱)的比较,属于高考的热点,掌握一强一弱的比较方法和技巧,在解题中能达到事半功倍的效果。下面结合自己的教学,谈谈几种比较方...
 [方法与规律j] 快速书写质子守恒的方法 作者:李开振 来源:未知 日期:2016-02-02 20:14:16 点击:28485 所属专题:质子守恒
[方法与规律j] 快速书写质子守恒的方法 作者:李开振 来源:未知 日期:2016-02-02 20:14:16 点击:28485 所属专题:质子守恒
质子守恒就是酸失去的质子和碱得到的质子数目相同,质子守恒和物料守恒,电荷守恒一样同为溶液中的三大守恒关系 电荷守恒 化合物电荷: ⒈ 化合物中元素正负化合价代数和为零 溶液电荷 ⒉ 溶液中所有阳离子所带的正电荷总数等于所有阴离子所带的负电荷总数 例:NaHCO 3 ...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。弱酸也可以制备强酸!!! 比如向 CuSO 4 溶液中加入 H 2 S 溶液生成 CuS 黑色沉淀和 ...
氧化还原滴定法: 1.特点: 氧化还原滴定法在药物分析中应用广泛,用于测定具有氧化性...
问题1: 在酸溶液中,H + 和OH - 的来源分别是什么?举例说明怎样计算由水电离产生...
电离平衡常数是高考中一个重要的必考考点,常考查电离平衡常数的计算、弱酸的相对强弱...
...
一、原理:影响水的电离平衡因素 H 2 O H + +OH - 1.25 ℃, → c (H + ) H2O = ...
...
电解质溶液中有关离子浓度的判断是近年化学高考的重要题型之一。解此类型题的关键是掌...