
|
学习小专题 |

|
学习小专题 |
 [方法与规律j] 电离平衡常数的相关计算 作者:王辉 来源:未知 日期:2017-06-26 15:19:41 点击:2013 所属专题:电离平衡常数
[方法与规律j] 电离平衡常数的相关计算 作者:王辉 来源:未知 日期:2017-06-26 15:19:41 点击:2013 所属专题:电离平衡常数
...
 [方法与规律j] 当无限稀释强酸、强碱溶液时pH是怎么变化的? 作者:姚小伟 来源:未知 日期:2017-04-17 15:04:44 点击:1879 所属专题:ph计算
[方法与规律j] 当无限稀释强酸、强碱溶液时pH是怎么变化的? 作者:姚小伟 来源:未知 日期:2017-04-17 15:04:44 点击:1879 所属专题:ph计算
当无限稀释强酸或强碱溶液时, c (H + )或 c (OH - )变化得很小,此时就不能忽略水的电离平衡的影响,即应将水电离出得H + 和OH - 得浓度计算在内。由于水电离出 c (H + )和 c (OH - )为1×10 -7 mol/L,则计算出 c (H + )或 c (OH - )值必小于或接近于1×10 -7 m...
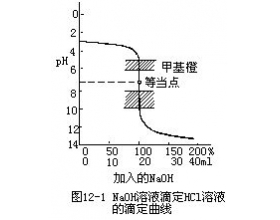 [方法与规律j] 中和滴定时,怎样选择酸碱指示剂 作者:蒋景耘 来源:未知 日期:2017-04-15 15:11:35 点击:5768 所属专题:指示剂选择
[方法与规律j] 中和滴定时,怎样选择酸碱指示剂 作者:蒋景耘 来源:未知 日期:2017-04-15 15:11:35 点击:5768 所属专题:指示剂选择
在实际操作时,用已知浓度的标准酸(或碱)慢慢滴入未知浓度的碱(或酸)中,到酸和碱的克当量数相等,这时称为等当点。中和反应达到等当点时,溶液外观一般没有变化,需要利用酸碱指示剂的变色作为到达等当点的信号。 选择一个合适的指示剂,一方面要了解指示剂的变色范围,另...
 [方法与规律j] 滴定终点的判断答题模板 作者:周四 来源:未知 日期:2017-03-19 18:44:27 点击:7815 所属专题:中和滴定
[方法与规律j] 滴定终点的判断答题模板 作者:周四 来源:未知 日期:2017-03-19 18:44:27 点击:7815 所属专题:中和滴定
当滴入最后一滴××××××标准溶液后,溶液变成××××××色,且半分钟内不恢复原来的颜色。 解答此类题目注意三个关键点: (1)最后一滴:必须说明是滴入“最后一滴”溶液。 (2)颜色变化:必须说明滴入“最后一滴”溶液后溶液“颜色的变化”。 (3)半分钟:必须说明溶液...
 [方法与规律j] 容器体积可变(恒压体系)的气体平衡计算 作者:陈桂芳 来源:古田一中 日期:2016-11-09 10:43:51 点击:4491 所属专题:平衡计算 恒压体系
[方法与规律j] 容器体积可变(恒压体系)的气体平衡计算 作者:陈桂芳 来源:古田一中 日期:2016-11-09 10:43:51 点击:4491 所属专题:平衡计算 恒压体系
在化学平衡计算中,恒温恒容与恒温恒压两个限制条件常常是重要的解题依据,恒温恒容的平衡体系中气体的物质的量之比等于气体的压强比,恒温恒压的平衡体系中气体的物质的量之比等于气体的体积比,不注意这两个条件限制的区别,解题时容易出错。尤其是密闭容器体积可变不一定...
 [工艺流程] 金属离子中混有铁离子的除杂问题探究 作者:鲁名峰 来源:古田一中 日期:2016-11-09 08:54:47 点击:3176 所属专题:铁离子 除杂 工艺流程
[工艺流程] 金属离子中混有铁离子的除杂问题探究 作者:鲁名峰 来源:古田一中 日期:2016-11-09 08:54:47 点击:3176 所属专题:铁离子 除杂 工艺流程
化工流程中提纯各种金属离子(混有杂质Fe 3+ )的除杂过程,常常加入相应价态的金属氧化物、氢氧化物、碳酸盐、碱式碳酸盐等为除杂试剂,可以使得Fe 3+ 离子转化为Fe(OH) 3 沉淀而除去。其中涉及什么样的反应原理?为什么? 案例1.现有含FeCl 2 杂质的氯化铜晶体(CuCl 2 ·...
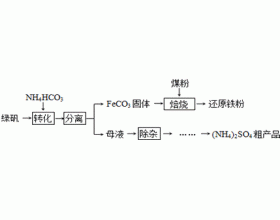 [方法与规律j] 为什么碳酸氢铵常做金属离子的沉淀剂? 作者:胡嘉谋 来源:古田一中 日期:2019-06-11 16:31:00 点击:6700 所属专题:沉淀分析法 沉淀转化 碳酸氢铵
[方法与规律j] 为什么碳酸氢铵常做金属离子的沉淀剂? 作者:胡嘉谋 来源:古田一中 日期:2019-06-11 16:31:00 点击:6700 所属专题:沉淀分析法 沉淀转化 碳酸氢铵
常说碳酸的酸式盐可溶,这就定性说明了金属离子与碳酸氢根离子混合可得到可溶性碳酸氢盐,难形成碳酸盐沉淀。但为什么在化工生产流程中金属离子的沉淀剂常用NH 4 HCO 3 而不直接用Na 2 CO 3 等可溶性碳酸盐?请看案例。 案例1.绿矾(FeSO 4 ·7H 2 O)的一种综合利用工艺...
 [方法与规律j] 二氧化碳通入盐或碱溶液中生成何种盐? 作者:张县 来源:古田一中 日期:2016-11-09 09:08:54 点击:4184 所属专题:强酸制弱酸 二氧化碳与盐 二氧化碳与碱
[方法与规律j] 二氧化碳通入盐或碱溶液中生成何种盐? 作者:张县 来源:古田一中 日期:2016-11-09 09:08:54 点击:4184 所属专题:强酸制弱酸 二氧化碳与盐 二氧化碳与碱
案例1.将少量或过量的CO 2 气体分别通入次氯酸钙溶液中,为什么前者生成正盐CaCO 3 ,后者生成酸式盐Ca(HCO 3 ) 2 ? 反应本质: 少量CO 2 气体:CO 2 +H 2 O+Ca(ClO) 2 ==CaCO 3 ↓+2HClO 过量CO 2 气体:2CO 2 +2H 2 O+Ca(ClO) 2 ==Ca(HCO 3 ) 2 +2HClO 定性分...
 [方法与规律j] 介绍一种书写双盐类水解反应离子方程式的方法 作者:吴键 来源:未知 日期:2016-11-03 15:17:18 点击:1177 所属专题:盐类水解方程式
[方法与规律j] 介绍一种书写双盐类水解反应离子方程式的方法 作者:吴键 来源:未知 日期:2016-11-03 15:17:18 点击:1177 所属专题:盐类水解方程式
...
 [方法与规律j] 中和滴定的拓展和计算 作者:童建军 来源:未知 日期:2020-01-31 15:18:40 点击:1146 所属专题:滴定法
[方法与规律j] 中和滴定的拓展和计算 作者:童建军 来源:未知 日期:2020-01-31 15:18:40 点击:1146 所属专题:滴定法
定性检验与定量实验是不同实验方法,定量实验中仪器选 择与数据的采集直接相关,所以实验中要根据实验精度要求选 择好合理的仪器,重点是滴定法(酸碱中和滴定、氧化还原滴 定、沉淀溶解滴定)、物质纯度测定(气体法、沉淀法、滴定法、差减法)。同时要关注实验操作、指示...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。弱酸也可以制备强酸!!! 比如向 CuSO 4 溶液中加入 H 2 S 溶液生成 CuS 黑色沉淀和 ...
氧化还原滴定法: 1.特点: 氧化还原滴定法在药物分析中应用广泛,用于测定具有氧化性...
问题1: 在酸溶液中,H + 和OH - 的来源分别是什么?举例说明怎样计算由水电离产生...
电离平衡常数是高考中一个重要的必考考点,常考查电离平衡常数的计算、弱酸的相对强弱...
...
一、原理:影响水的电离平衡因素 H 2 O H + +OH - 1.25 ℃, → c (H + ) H2O = ...
...
电解质溶液中有关离子浓度的判断是近年化学高考的重要题型之一。解此类型题的关键是掌...