
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
质子平衡式是用物质的量浓度表示得失质子(指氢离子)数相等的方程式。其书写方法有很多,现有以下几种比较简便的方法:
1.关系式法
关系式法的使用关键是找出溶液中各物质之间的平衡关系,并依据平衡条件,即
碱得到的质子总数==酸放出的质子总数
如:醋酸溶液中质子平衡式的推导方法
在醋酸溶液中存在如下平衡关系
![]()
则:c(Ac-)= HAc释放出的水合氢离子浓度;c(OH-)=水释放出的水合氢离子浓度
故c(H3O+)总= c(Ac-)+ c(OH-),简写为:c(H+)总= c(Ac-)+ c(OH-)
又如:Na2CO3溶液中质子平衡式的推导方法
Na2CO3在水中存在如下平衡和等量关系,溶液中OH-离子的来源有三种途径:
⑴水的电离:H2O![]() H++OH-;水电离产生的OH-和H+相等。
H++OH-;水电离产生的OH-和H+相等。
⑵CO32-离子水解::
①CO32-+ H2O ![]() HCO3-+ OH-
HCO3-+ OH-
②HCO3-+ H2O![]() H2CO3+ OH-
H2CO3+ OH-
①②两步中水解产生的OH-都是由CO32-离子水解所得,由于起始溶质是CO32-离子,不妨将①②两步分开计算,即可看作部分CO32-只发生一级水解,产生HCO3-,则有
CO32-+ H2O![]() HCO3-+ OH-
HCO3-+ OH-
即CO32-离子一级水解产生的OH-和HCO3-相等。
另一部分CO32-发生水解产生H2CO3,
③CO32-+ H2O ![]() H2CO3+ 2OH-
H2CO3+ 2OH-
即部分CO32-离子发生两级水解产生的OH-离子是H2CO3分子物质的量的两倍。
由上述定量关系,可推出如下酸碱质子平衡式:
c(OH-)=c(H+)+ c(HCO3-)+2 c(H2CO3)
(1)选出能给出质子和结合质子的基准态物质(包括水),列于方框内;
(3)利用下列公式求算:
酸失去的质子数(mol)=对应碱的浓度×该酸在反应中失去的质子数;
碱得到的质子数(mol)=对应酸的浓度×该碱在反应中得到的质子数;
(4)列质子平衡式。即依据酸失去的质子数(mol)与碱得到的质子数(mol)相等的关系,列出质子平衡式。
如在Na2S的水溶液中,建立质子平衡式,按上述步骤则有:
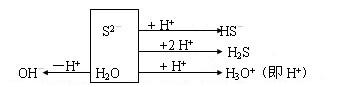
框图左侧为物质失去质子后得到的粒子,右侧为物质得到质子后形成的粒子。依据得失质子相等的关系,可知:
故质子平衡式为:
c(OH-)= c(HS-)+2 c(H2S)+ c(H+)
即c(H+)= c(OH-)-c(HS-)-2 c(H2S)。
基准态微粒的选取是正确书写的前提。一般水既能给出质子又能结合质子,即自身电离。常见的弱碱阳离子中有NH4+能给出质子,弱酸阴离子都能结合质子,弱酸的酸式根离子(如HCO3-)既能给出质子又能结合质子。
3.物料——电荷法
即建立质子平衡式的方法是由物料平衡式与电荷等衡式推出的,方法是先推出物料平衡式和电荷等衡式,再由两式相减即得。
如在Na2CO3溶液中,物料平衡式的推导如下:
若Na2CO3溶液的物质的量浓度为1mol/L,则c(Na+)=2mol/L,假定CO32-离子不水解,则c(CO32-)=1 mol/L。实际上,Na2CO3为强碱弱酸盐,CO32-离子能部分水解,CO32-离子水解后变成了HCO3-和H2CO3,由于水解是可逆的、微弱的,溶液中还有大量的未水解的CO32-离子。根据碳元素守恒,Na2CO3中的CO32-离子在溶液中以HCO3-、H2CO3和CO32-三种形态存在,三种粒子浓度之和等于1mol/L。所以,物料平衡式为:
c(CO32-)+ c(HCO3-)+ c(H2CO3)=1mol/L=c(Na+)/2
或c(Na+)= 2c(CO32-)+ 2c(HCO3-)+ 2c(H2CO3)=2 mol/L……①
Na2CO3溶液中的电荷平衡式推导如下:
在Na2CO3溶液中,存在如下关系式:
Na2CO3=2Na++CO32-
H2O ![]() H++OH-
H++OH-
CO32-+ H2O![]() HCO3-+ OH-
HCO3-+ OH-
HCO3-+ H2O![]() H2CO3+ OH-
H2CO3+ OH-
由上述关系式可知,在Na2CO3溶液中存在的阳离子有Na+和H+,阴离子有HCO3-、CO32-和OH-。根据溶液呈电中性的原则,则阳离子所带的正电荷数等于阴离子所带的负电荷数。由此,电荷平衡式为:
c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)……②
由②-①(或将①中钠离子浓度代入②)并整理得:
c(H+)= c(OH-)-c(HCO3-)-2 c(H2CO3)……③
③式即为质子平衡式。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。弱酸也可以制备强酸!!! 比如向 CuSO 4 溶液中加入 H 2 S 溶液生成 CuS 黑色沉淀和 ...
氧化还原滴定法: 1.特点: 氧化还原滴定法在药物分析中应用广泛,用于测定具有氧化性...
问题1: 在酸溶液中,H + 和OH - 的来源分别是什么?举例说明怎样计算由水电离产生...
电离平衡常数是高考中一个重要的必考考点,常考查电离平衡常数的计算、弱酸的相对强弱...
...
一、原理:影响水的电离平衡因素 H 2 O H + +OH - 1.25 ℃, → c (H + ) H2O = ...