
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
电解质溶液属于混合体系。因电解质溶液能够发生电离、水解等反应,使得溶液中存在着多种形式的微粒,微粒的浓度也因此而变化。下面是笔者的一些探讨,供参考。
一、守恒关系
(1)电荷守恒:电解质溶液中阳离子所带的正电荷总数等于阴离子所带的负电荷总数。值得注意的是:①电荷守恒不一定是阴、阳离子数相等;②电荷总数通常是用各种阳(阴)离子浓度乘以该离子所带的正(负)电荷数的积总和表示。
(2)物料守恒:电解质溶液中某种特定的元素因水解或电离存在多种形式,该元素的原子总数是不会改变的,其实质是原子守恒。值得注意的是:①可以根据溶质化学式的定组成关系,列出物料守恒的关系式;②应用时,须弄清电解质溶液中存在的各种变化,找全该元素存在的各种形式,不能遗漏。
(3)质子守恒:电解质溶液中得到质子( 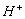 )的总数等于失去质子总数,它体现了
)的总数等于失去质子总数,它体现了
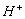 间的转移关系,即水电离出
间的转移关系,即水电离出
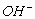 的量始终等于水电离出
的量始终等于水电离出
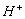 的量。值得注意的是:①质子守恒关系式可以由电荷守恒、物料守恒关系式推导出;②应用时,若守恒关系中同时出现分子和离子,且不是物料守恒,可以考虑是否为质子守恒。
的量。值得注意的是:①质子守恒关系式可以由电荷守恒、物料守恒关系式推导出;②应用时,若守恒关系中同时出现分子和离子,且不是物料守恒,可以考虑是否为质子守恒。
例1. 0.1 mol/L 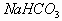 溶液中,下列关系正确的是(
)
溶液中,下列关系正确的是(
)
A. 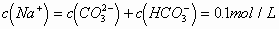
B. 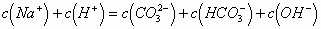
C. 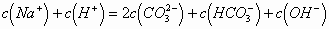
D. 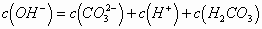
解析:根据 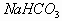 溶液中存在的电离、水解关系,得出溶液中存在
溶液中存在的电离、水解关系,得出溶液中存在
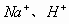 、
、
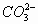 、
、
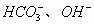 五种离子。
五种离子。
根据电荷守恒,得出:
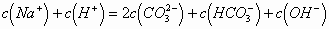
根据物料守恒,得出:
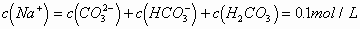
根据质子守恒,得出:
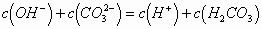
故C项正确,选C。
二、主次关系
对于反应混合型的溶液,应该全面分析反应过程,找出溶液存在的平衡关系和主次关系,其中以电离为主的溶液呈酸性,如 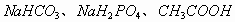 和
和
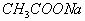 的混合溶液;以水解为主的溶液呈碱性,主要是除
的混合溶液;以水解为主的溶液呈碱性,主要是除
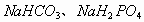 以外的多元弱酸强碱盐及NaCN和HCN的混合溶液。
以外的多元弱酸强碱盐及NaCN和HCN的混合溶液。
例2. 将0.1 mol/L 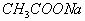 溶液20
mL与0.1 mol/L
溶液20
mL与0.1 mol/L 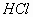 水溶液10
mL混合后,溶液呈酸性,则溶液中有关粒子的浓度关系正确的是()
水溶液10
mL混合后,溶液呈酸性,则溶液中有关粒子的浓度关系正确的是()
A. 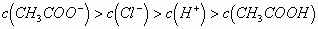
B. 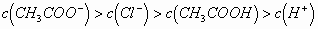
C. 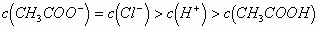
D. 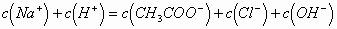
解析:两溶液混合后发生的反应为:
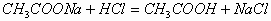
开始时: 0.002mol 0.001mol
反应后: 0.001 mol(剩余)0 0.001 mol 0.001 mol
即反应后的溶质为 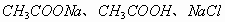 ,且三者
,且三者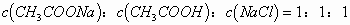
对于该混合溶液,存在下列平衡关系:
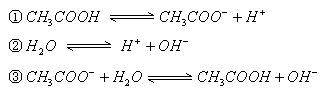
可见,溶液中分子为: 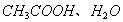 ,离子为:
,离子为:
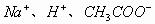 、
、
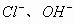 。因溶液呈酸性,说明决定溶液酸碱性的主要因素是①,次要因素是③,即
。因溶液呈酸性,说明决定溶液酸碱性的主要因素是①,次要因素是③,即
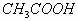 电离程度大于
电离程度大于
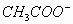 的水解程度,得出:
的水解程度,得出: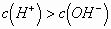 、
、
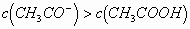
再根据物料守恒,得出: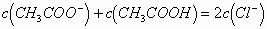
即: 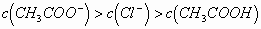
另外,溶液 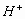 主要来源于
主要来源于
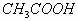 的电离(量很小,是次要离子),故B项正确。再根据电荷守恒,得出D项正确,选B、D。
的电离(量很小,是次要离子),故B项正确。再根据电荷守恒,得出D项正确,选B、D。
三、大小关系
(1)对于弱酸、弱碱溶液电离程度小,产生的离子浓度远远的小于弱电解质分子的浓度,它主要适用于弱电解质溶液中微粒浓度大小比较的题型。如0.1 mol/L
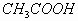 溶液微粒浓度大小关系为:
溶液微粒浓度大小关系为:
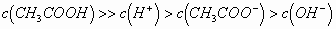
(2)对于含一种弱根离子的盐溶液,水解程度一般很小,水解产生的离子或分子浓度远远小于弱根离子,它主要适用含一种弱根离子的盐溶液中微粒浓度大小比较的题型。如
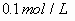
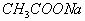 溶液微粒浓度大小关系为:
溶液微粒浓度大小关系为: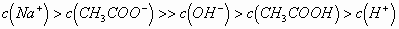
四、相互影响关系
如果加入影响平衡移动的某种离子,导致平衡发生了移动,根据勒沙特勒原理,达到新平衡时各微粒的浓度将发生变化。
例3. 物质的量浓度相同的下列溶液中, 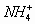 浓度最大的是(
)
浓度最大的是(
)
A. 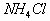 B.
B.
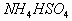 C.
C. 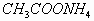 D.
D.
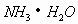
解析:(A)为强酸弱碱盐, 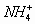 发生水解,没有其它因素影响属于正常水解。(B)属于强酸酸式盐,
发生水解,没有其它因素影响属于正常水解。(B)属于强酸酸式盐,
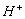 完全电离,电离出
完全电离,电离出
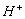 又抑制
又抑制
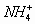 的水解,使得溶液中
的水解,使得溶液中
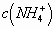 减少的程度变小。(C)属于弱酸弱碱盐,
减少的程度变小。(C)属于弱酸弱碱盐,
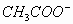 和
和
 相互促进水解(双水解),使得溶液中
相互促进水解(双水解),使得溶液中
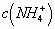 减小的程度加大。(D)是弱电解质电离出的
减小的程度加大。(D)是弱电解质电离出的
 较小,
较小,
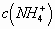 极小。可见,
极小。可见,
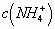 大小顺序为:(B)>(A)>(C)>(D),最大的是(B),选(B)。
大小顺序为:(B)>(A)>(C)>(D),最大的是(B),选(B)。
可见,酸性越强的溶液,抑制  水解的程度越大,
水解的程度越大,
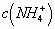 越大;反之,碱性越强,
越大;反之,碱性越强,
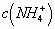 越小。
越小。
五、自我调节关系
对于弱酸、弱酸盐或弱碱、弱碱盐组成的混合溶液,能在一定的范围内抵制外加的少量酸、碱或稀释的影响,通过自身的调节,pH不发生显著变化。
如 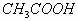 和
和
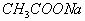 的混合溶液,存在:
的混合溶液,存在:
(1) 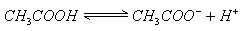
(2) 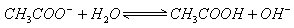 。
。
加入少量的强酸后,实质是加少量的
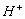 ,使得(1)向逆反应方向移动,(2)向正反应移动,
,使得(1)向逆反应方向移动,(2)向正反应移动,
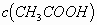 略有增大,
略有增大,
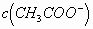 略有减小,但
略有减小,但
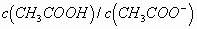 的比值变化很小,溶液中
的比值变化很小,溶液中
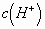 基本不变。反之,加强碱(实质是加
基本不变。反之,加强碱(实质是加
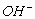 ),
),
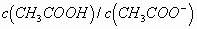 同样变化很小。加水稀释,使得
同样变化很小。加水稀释,使得
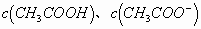 同时减小,其比值仍保持基本不变,pH变化不大。
同时减小,其比值仍保持基本不变,pH变化不大。
另外,对于上述混合溶液具有一定的调节范围,一般而言,当c(盐)与c(酸)相等时,溶液的调节能力最强。
可见,在处理溶液中微粒浓度关系时,往往是几个关系同时考虑,综合应用,唯有这样,才能理顺复杂混合溶液中微粒浓度间的关系,轻松愉快的解题。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。弱酸也可以制备强酸!!! 比如向 CuSO 4 溶液中加入 H 2 S 溶液生成 CuS 黑色沉淀和 ...
氧化还原滴定法: 1.特点: 氧化还原滴定法在药物分析中应用广泛,用于测定具有氧化性...
问题1: 在酸溶液中,H + 和OH - 的来源分别是什么?举例说明怎样计算由水电离产生...
电离平衡常数是高考中一个重要的必考考点,常考查电离平衡常数的计算、弱酸的相对强弱...
...
一、原理:影响水的电离平衡因素 H 2 O H + +OH - 1.25 ℃, → c (H + ) H2O = ...