
|
学习小专题 |

|
学习小专题 |
 [方法与规律j] 混合溶液pH计算的0.3规则 作者:王金玉 来源:摘抄于因特网 日期:2016-02-02 19:02:15 点击:17988 所属专题:ph计算
[方法与规律j] 混合溶液pH计算的0.3规则 作者:王金玉 来源:摘抄于因特网 日期:2016-02-02 19:02:15 点击:17988 所属专题:ph计算
两溶液等积混合求溶液pH的0.3规则的内容可叙述如下: 两种强酸溶液,或两种强碱溶液,或一种强酸溶液与一种强碱溶液等体积混合, 当两溶液的pH 值之和为14 时,混合液pH =7 ; 当两溶液的pH 值之和小于13 时,混合液的pH 值为原pH 值小的加上0.3 ; 当两溶液的pH 值之...
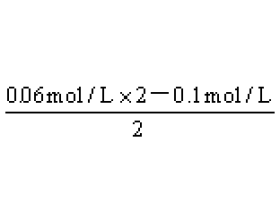 [方法与规律j] pH的技巧计算 作者:周广 来源:摘抄于因特网 日期:2013-05-02 18:04:18 点击:16414 所属专题:ph计算
[方法与规律j] pH的技巧计算 作者:周广 来源:摘抄于因特网 日期:2013-05-02 18:04:18 点击:16414 所属专题:ph计算
1.用pOH计算碱及碱性溶液 碱溶液及混合后显碱性的溶液算pH值时可先算pOH,后算pH。 pOH = -lg{ c (OH - )} ,pH +pOH =14 。 例1.等体积混合0.1 mol / L盐酸和0.06 mol / L Ba(OH) 2 溶液后,溶液的pH等于 ( D ) A. 2.0 B. 12.3 C. 1.7 D. 12.0 解析:强酸与强...
 [方法与规律j] 离子浓度大小的比较 作者:欧阳文兵 来源:摘抄于因特网 日期:2005-12-08 09:49:46 点击:11813 所属专题:离子浓度大小比较 比较
[方法与规律j] 离子浓度大小的比较 作者:欧阳文兵 来源:摘抄于因特网 日期:2005-12-08 09:49:46 点击:11813 所属专题:离子浓度大小比较 比较
一、离子浓度大小的比较 这类问题包括一种物质的溶液和两种物质的溶液。具体分析问题和解题是要先整体,后局部;先宏观,后微观。对于一种电解质溶液,先观看,后分析;对于两种电解质混合的溶液,由于反应,则应先计算,后观看。具体解题思路是:算相关的物质的量,看...
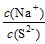 [方法与规律j] 哪些问题要考虑盐类水解 作者:祝其君 来源:摘抄于因特网 日期:2016-02-02 12:12:30 点击:23400 所属专题:盐类水解应用
[方法与规律j] 哪些问题要考虑盐类水解 作者:祝其君 来源:摘抄于因特网 日期:2016-02-02 12:12:30 点击:23400 所属专题:盐类水解应用
我们知道,盐类按照组成可分为一般简单的盐和复盐、络盐,一般盐又可以分为正盐、酸式盐和碱式盐。盐按照其水溶液的酸碱性,又可以分为中性盐、酸性盐和碱性盐。盐按其能否水解又可分为水解盐(包括强酸弱碱盐、强碱弱酸盐和弱酸弱碱盐)和非水解盐(强酸强碱盐)。盐与盐...
 [方法与规律j] 浅谈两种电解质溶液混合后离子浓度的判断 作者:樊会武 来源:摘抄于因特网 日期:2022-08-12 15:49:39 点击:11779 所属专题:离子浓度大小比较
[方法与规律j] 浅谈两种电解质溶液混合后离子浓度的判断 作者:樊会武 来源:摘抄于因特网 日期:2022-08-12 15:49:39 点击:11779 所属专题:离子浓度大小比较
电解质溶液中有关离子浓度的判断是近年化学高考的重要题型之一。解此类型题的关键是掌握“两平衡、两原理”,即弱电解质的电离平衡、盐的水解平衡和电解质溶液中的电荷守恒、物料守恒原理。下面就有关两种电解质溶液相混合离子浓度的判断谈谈自己在教学中的体会。 例1...
 [方法与规律j] 常见盐类水解应用17例 作者:王利平 来源:摘抄于因特网 日期:2022-08-06 15:38:11 点击:23785 所属专题:盐类水解应用
[方法与规律j] 常见盐类水解应用17例 作者:王利平 来源:摘抄于因特网 日期:2022-08-06 15:38:11 点击:23785 所属专题:盐类水解应用
盐类水解是中学化学教学中的重点和难点。也是近年来高考的热点之一。但是同学们在实际应用中却往往不知何时考虑有关盐类水解。现将有关常见的盐类水解问题归纳如下: (1) 判断盐溶液的酸碱性时应考虑盐类水解,强酸弱碱盐溶液水解显酸性,强碱弱酸盐水解显碱性.弱酸弱碱...
 [方法与规律j] 盐类水解规律及离子方程式的书写 作者:韩富军 来源:摘抄于因特网 日期:2022-08-05 17:49:43 点击:19491 所属专题:盐类水解方程式 盐类水解规律
[方法与规律j] 盐类水解规律及离子方程式的书写 作者:韩富军 来源:摘抄于因特网 日期:2022-08-05 17:49:43 点击:19491 所属专题:盐类水解方程式 盐类水解规律
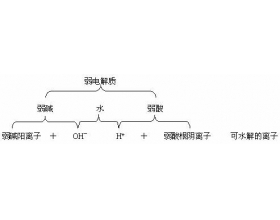
一、盐类水解的四大规律 1. 什么离子水解? 根据盐类水解的定义,知盐类水解的关键是生成了弱电解质。由下图示可知。 因此, 盐中的弱离子 (弱碱阳离子和弱酸根阴离子)一定要发生水解。 2. 什么盐水解? 强酸和弱碱所生成的盐叫强酸弱碱盐,强碱与弱酸所生成的盐叫强碱...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。弱酸也可以制备强酸!!! 比如向 CuSO 4 溶液中加入 H 2 S 溶液生成 CuS 黑色沉淀和 ...
氧化还原滴定法: 1.特点: 氧化还原滴定法在药物分析中应用广泛,用于测定具有氧化性...
问题1: 在酸溶液中,H + 和OH - 的来源分别是什么?举例说明怎样计算由水电离产生...
电离平衡常数是高考中一个重要的必考考点,常考查电离平衡常数的计算、弱酸的相对强弱...
...
一、原理:影响水的电离平衡因素 H 2 O H + +OH - 1.25 ℃, → c (H + ) H2O = ...
...
电解质溶液中有关离子浓度的判断是近年化学高考的重要题型之一。解此类型题的关键是掌...