
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
常说碳酸的酸式盐可溶,这就定性说明了金属离子与碳酸氢根离子混合可得到可溶性碳酸氢盐,难形成碳酸盐沉淀。但为什么在化工生产流程中金属离子的沉淀剂常用NH4HCO3而不直接用Na2CO3等可溶性碳酸盐?请看案例。
案例1.绿矾(FeSO4·7H2O)的一种综合利用工艺如下:
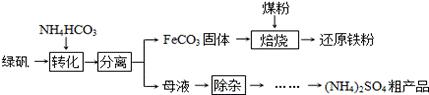
绿矾与NH4HCO3在溶液中按物质的量之比1∶2反应,写出该反应的离子方程式。
案例2.工业上可用软锰矿(主要成分是MnO2)为主要原料制备高性能磁性材料碳酸锰(MnCO3)。在沉锰工序中,向含有Mn2+的溶液中加入NH4HCO3得到MnCO3生成。
案例3.碳酸锶大量用于生产彩色电视显像管的荧光屏玻璃。工业上常以天青石(主要成分为硫酸锶)为原料制取碳酸锶。若向含有Sr2+的溶液中加入碳酸氢铵生成沉淀。写出该反应的离子方程式。
案例4.某锂离子电池正极材料有钴酸锂(LiCoO2)等。在回收钴的工艺流程中,沉钴反应是在硫酸钴溶液中加入NH4HCO3。写出该反应的化学方程式。
案例5.下面是一种已获得专利的KNO3制备方法的主要步骤:
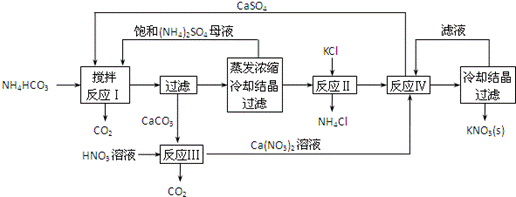
写出反应Ⅰ中CaSO4与NH4HCO3反应的化学方程式。
案例6.锌浮渣主要含Zn、ZnO、SiO2、Fe2+、Cd2+、Mn2+,工业上可通过控制条件逐一除去杂质以制备超细活性氧化锌,其工艺流程如下:
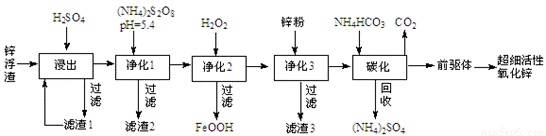
在50℃时进行
答案:1.Fe2++2HCO3-==FeCO3↓+CO2↑+H2O
2.Mn2++2HCO3-==MnCO3↓+CO2↑+H2O
3.Sr2++2HCO3-==SrCO3↓+CO2↑+H2O
4.COsO4+2NH4HCO3==COCO3↓+(NH4)2SO4+CO2↑+H2O
5.CaSO4+2NH4HCO3==CaCO3↓+CO2↑+H2O+ (NH4)2SO4
6.3ZnsO4+6NH4HCO3==ZnCO3·2Zn(OH)2·H2O↓+3(NH4)2SO4+5CO2↑
发散思维:事实上,许多金属离子如等Ba2+、Cd2+、Ni2+、Cu2+、Pb2+、Ce3+等均会发生上述类似反应。
Ba2++2HCO3-==BaCO3↓+CO2↑+H2O
Cd2++2HCO3-==CdCO3↓+CO2↑+H2O
Ni2++2HCO3-==NiCO3↓+CO2↑+H2O
Cu2++2HCO3-==CuCO3↓+CO2↑+H2O
Pb2++2HCO3-==PbCO3↓+CO2↑+H2O
2Ce3++6HCO3-==Ce2(CO3)3↓+3CO2↑+3H2O
错因分析:学生常常错写此类离子方程式,以案例1为例。
Fe2++2OH-==Fe(OH)2↓(NH4HCO3溶液中OH-浓度很小,不能生成碱沉淀)
Fe2++CO32-==FeCO3↓(酸式根离子HCO3-不能拆)
Fe2++2HCO3-== Fe(OH)2↓+ 2CO2↑(二者不是发生双水解反应)
Fe2++HCO3-==FeCO3↓+H+( FeCO3与H+不共存)
理解:Fe2++HCO3-==FeCO3↓+H+,H++HCO3-==CO2↑+H2O
合并两个反应得总式:Fe2++2HCO3-==FeCO3↓+CO2↑+H2O
定性分析:欲使金属离子形成碳酸盐沉淀,常见的沉淀剂有Na2CO3、CaCO3、NaHCO3、NH4HCO3等。可溶性的Na2CO3能与金属离子直接生成难溶碳酸盐而沉淀析出。难溶性的CaCO3是利用沉淀转化原理,使一些金属离子生成溶解度更小的碳酸盐而沉淀析出。很明显,可溶性的NaHCO3、NH4HCO3是利用难溶碳酸盐的溶度积较小,在一定浓度的NaHCO3、NH4HCO3溶液中的CO32-浓度与金属离子浓度的乘积若大于这些难溶碳酸盐的溶度积,即可得到碳酸盐沉淀。而NH4HCO3的溶解度大、易洗涤、副产物易挥发、污染也较小,原料来源广泛、价格也低。过量时,受热易分解,便于分离除去。故常用NH4HCO3做金属离子的沉淀剂。
定量分析:以上这些金属离子为什么主要生成碳酸盐沉淀而不易生成氢氧化物沉淀?这实际上与加入NH4HCO3溶液中的OH-(即溶液pH)、CO32-的浓度大小有关。定性问题可借助于的溶度积定量解决。以案例1为例定量计算。
已知:Ka1(H2CO3) =4.2×10-7,Ka2(H2CO3) =5.6×10-11,Kb(NH3·H2O) =1.8×10-5;Ksp[Fe(OH)2]=1.6×10-14,Ksp[FeCO3]=3.2×10-11。
在0.1mol·L-1NH4HCO3溶液中,存在NH4+、HCO3-的水解平衡,可列出平衡常数表达式如下:
NH4++HCO3-+H2O NH3·H2O+ H2CO3
NH3·H2O+ H2CO3
K=[c(NH3·H2O)×c(H2CO3)]÷[c(NH4+)×c(HCO3-)]=Kw÷(Kb×Ka1)
pH=7+1/2pKa1﹣1/2pKb≈7.8,c(H+)=10-7.8mol·L-1,c(OH-)=10-6.2mol·L-1,
c(CO32-)=[Ka2×c(HCO3-)]÷c(H+)=5.6×10-4·2mol·L-1,
在0.1mol·L-1NH4HCO3溶液中,含有的CO32-的浓度远大于OH-,故生成的沉淀是FeCO3而非Fe(OH)2。
若这些金属离子形成碳酸盐完全沉淀,c(Mn+)≤10-5mol·L-1,设n=2。
Q=c(M2+)×c(CO32-)约为10-9,浓度商Q一般均会大于各种碳酸盐的Ksp(见下表)。
若个别碳酸盐的Ksp大于浓度商Q,可提高NH4HCO3溶液的浓度或采用固体NH4HCO3,使之Q大于Ksp,就可得到碳酸盐沉淀。
部分碳酸盐的溶度积表
化 | Ksp | 化 | Ksp | 化 | Ksp |
BaCO3 CaCO3 CdCO3 COCO3 | 5.1×10-9 2.8×10-9 5.2×10-12 1.4×10-13 | MnCO3 CuCO3 FeCO3 MgCO3 | 1.8×10-11 1.4×10-10 3.2×10-11 3.5×10-8 | NiCO3 PbCO3 SrCO3 ZnCO3 | 6.6×10-9 7.4×10-14 1.1×10-10 1.4×10-11 |
当然,金属离子要形成碳酸盐沉淀,不仅与溶液中的OH-、CO32-等离子浓度大小有关,还与温度等条件有关,反应条件改变,沉淀形式也可能变化。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
双指示剂法是一种利用两种具有不同变色范围的酸碱指示剂,在...
弱酸也可以制备强酸!!! 比如向 CuSO 4 溶液中加入 H 2 S 溶液生...
氧化还原滴定法: 1.特点: 氧化还原滴定法在药物分析中应用广...
问题1: 在酸溶液中,H + 和OH - 的来源分别是什么?举例说明...
电离平衡常数是高考中一个重要的必考考点,常考查电离平衡常...
...