
|
学习小专题 |

|
学习小专题 |
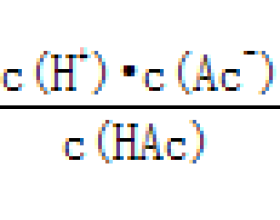 [方法与规律j] 温度变化时盐溶液pH及AG变化分析 作者:化学自习室 来源:未知 日期:2019-12-09 20:23:19 点击:1344 所属专题:酸碱性判断
[方法与规律j] 温度变化时盐溶液pH及AG变化分析 作者:化学自习室 来源:未知 日期:2019-12-09 20:23:19 点击:1344 所属专题:酸碱性判断
醋酸钠溶液 : ∵ K a = c (H + )= K a c (OH - )= c (H + )+ c (HAc)(质子守恒) ∴ = =1+ =1+ 当温度升高时: K a 增大(升温促进电离) c (Ac - )减小, c (HAc)增大(升温促进水解) ∴升高温度时 c (H + )增大,pH减小; 减小,AG增大,溶液碱性减弱。 碳酸钠溶液:...
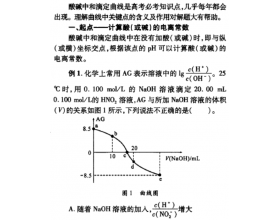 [方法与规律j] 酸碱中和滴定曲线中的几个关键点 作者:殷红燕 来源:未知 日期:2019-10-31 08:53:30 点击:2866 所属专题:中和滴定曲线
[方法与规律j] 酸碱中和滴定曲线中的几个关键点 作者:殷红燕 来源:未知 日期:2019-10-31 08:53:30 点击:2866 所属专题:中和滴定曲线
...
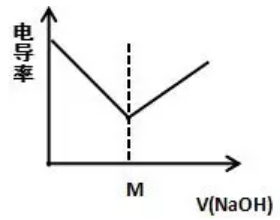 [方法与规律j] 四类中和滴定的电导率曲线规律 作者:张安荣 来源:未知 日期:2020-03-11 10:00:00 点击:11317 所属专题:中和滴定曲线 电导率曲线
[方法与规律j] 四类中和滴定的电导率曲线规律 作者:张安荣 来源:未知 日期:2020-03-11 10:00:00 点击:11317 所属专题:中和滴定曲线 电导率曲线
【电导率的意义】 电导率是用来描述物质中电荷流动难易程度的参数。高中阶段可从导电性的角度来理解: (1)当溶液中离子浓度越大时,溶液电导率越大; (2)当溶质离子浓度相同时,离子所带电荷越大时,溶液电导率越大。 同浓度的一元酸碱中和时,电导率大小规律: (1)强里...
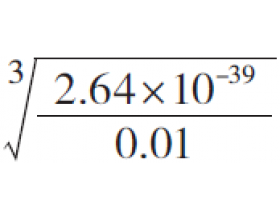 [方法与规律j] 如何求难溶氢氧化物开始沉淀和沉淀完全时的pH ? 作者:蔡惠君 来源:未知 日期:2020-07-17 11:13:35 点击:12085 所属专题:金属离子沉淀pH值 氢氧化物沉淀 pH调节
[方法与规律j] 如何求难溶氢氧化物开始沉淀和沉淀完全时的pH ? 作者:蔡惠君 来源:未知 日期:2020-07-17 11:13:35 点击:12085 所属专题:金属离子沉淀pH值 氢氧化物沉淀 pH调节
例9 某溶液中含杂质Fe 3+ 为0.01 mol·L -1 ,已知室温下Fe(OH) 3 的 K sp =2.64×10 -39 ,计算(1)开始生成Fe(OH) 3 沉淀的pH;(2)Fe 3+ 沉淀完全时的pH。(被沉淀离子浓度小于1.0×10 -5 mol·L -1 时, 可以认为已沉淀完全) 解析:开始沉淀和沉淀完全时Fe 3+ ...
 [方法与规律j] 如何定量判断弱酸酸式盐溶液酸碱性 作者:化学自习室 来源:未知 日期:2021-03-05 16:22:04 点击:2308 所属专题:酸式盐 酸碱性判断
[方法与规律j] 如何定量判断弱酸酸式盐溶液酸碱性 作者:化学自习室 来源:未知 日期:2021-03-05 16:22:04 点击:2308 所属专题:酸式盐 酸碱性判断
例3 常温下,0.1mol·L -1 NaHSO 3 溶液呈 (填“酸性”“中性”或“碱性”)? 分析:HS O 3 - +H 2 O H 2 SO 3 +OH - 使溶液呈碱性 HS O 3 - S O 3 2 - +H + 使溶液呈酸性 溶液的酸碱性取决于水解占主要的,还是电离占主要的. 如何判断两个反应谁是主要的呢? ...
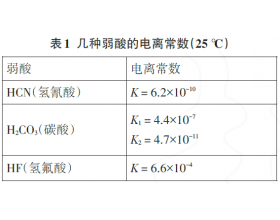 [方法与规律j] 利用“交叉”规律分析“强酸制取弱酸”原理 作者:化学自习室 来源:未知 日期:2021-12-16 09:15:22 点击:3148 所属专题:强酸制弱酸
[方法与规律j] 利用“交叉”规律分析“强酸制取弱酸”原理 作者:化学自习室 来源:未知 日期:2021-12-16 09:15:22 点击:3148 所属专题:强酸制弱酸
学生对强酸制取弱酸规律并不陌生,可当给定反应物酸“过量”或“少量”时,学生往往对于生成的盐是“正盐”还是“酸式盐”搞不清楚. 例2 (1)向Na 2 CO 3 溶液中加入少量HF溶液,反应离子方程式为 (数据参照表1 ,下同);若加入过量HF溶液,反应离子方程式为 ; (2)向NaC...
 [方法与规律j] 运用溶度积计算平衡常数解答疑难问题 作者:宴雄 来源:未知 日期:2019-06-12 15:45:47 点击:1722 所属专题:溶度积 沉淀转化
[方法与规律j] 运用溶度积计算平衡常数解答疑难问题 作者:宴雄 来源:未知 日期:2019-06-12 15:45:47 点击:1722 所属专题:溶度积 沉淀转化
对于人教版《化学反应原理》“难溶电解质的溶解平衡”一节,学生存在疑难问题较多。主要集中在几个与溶度积相关的化学反应。而对于化学反应进行的程度最有说服力的是平衡常数的大小,运用溶度积计算出平衡常数能帮助学生解答几个疑难问题。 1 与Mg(OH) 2 沉淀相关的反应...
 [方法与规律j] 混合溶液中电离平衡常数的计算 作者:王春 来源:未知 日期:2019-06-03 08:54:52 点击:1189 所属专题:电离平衡常数
[方法与规律j] 混合溶液中电离平衡常数的计算 作者:王春 来源:未知 日期:2019-06-03 08:54:52 点击:1189 所属专题:电离平衡常数
...
 [方法与规律j] 深度学习分布曲线 作者:淮畔化学 来源:未知 日期:2019-05-13 09:34:15 点击:1515 所属专题:分布曲线
[方法与规律j] 深度学习分布曲线 作者:淮畔化学 来源:未知 日期:2019-05-13 09:34:15 点击:1515 所属专题:分布曲线
...
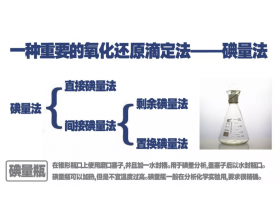 [方法与规律j] 碘量法的原理与应用 作者:淮畔化学 来源:未知 日期:2019-05-13 09:20:47 点击:16814 所属专题:碘量法 滴定法
[方法与规律j] 碘量法的原理与应用 作者:淮畔化学 来源:未知 日期:2019-05-13 09:20:47 点击:16814 所属专题:碘量法 滴定法
一、碘量法的基本原理 1、直接碘量法 直接碘量法是用碘滴定液直接滴定还原性物质的方法。在滴定过程中,I2被还原为I-: 直接碘量法只能在酸性、中性或弱碱性溶液中进行,如果溶液pH>9,可发生副反应使测定结果不准确。 直接碘量法可用淀粉指示剂指示终点。淀粉遇碘显蓝...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。弱酸也可以制备强酸!!! 比如向 CuSO 4 溶液中加入 H 2 S 溶液生成 CuS 黑色沉淀和 ...
氧化还原滴定法: 1.特点: 氧化还原滴定法在药物分析中应用广泛,用于测定具有氧化性...
问题1: 在酸溶液中,H + 和OH - 的来源分别是什么?举例说明怎样计算由水电离产生...
电离平衡常数是高考中一个重要的必考考点,常考查电离平衡常数的计算、弱酸的相对强弱...
...
一、原理:影响水的电离平衡因素 H 2 O H + +OH - 1.25 ℃, → c (H + ) H2O = ...
...
电解质溶液中有关离子浓度的判断是近年化学高考的重要题型之一。解此类型题的关键是掌...