
|
学习小专题 |

|
学习小专题 |
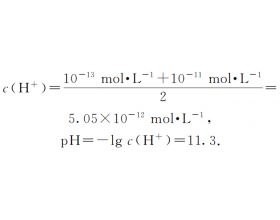 [方法与规律j] 关于pH计算与测定的问题讨论 作者:王笃年 来源:未知 日期:2021-10-29 15:10:50 点击:1003 所属专题:pH计算
[方法与规律j] 关于pH计算与测定的问题讨论 作者:王笃年 来源:未知 日期:2021-10-29 15:10:50 点击:1003 所属专题:pH计算
问题1、不同pH溶液混合时,计算混合液的pH何时以H + 为准,何时以OH - 为准? 请看如下实例:把pH=13和pH=11的烧碱溶液等体积混合,求混合溶液的pH。 解法1:混合溶液的 解法2: 两溶液的 c (OH - )分别为10 -1 mol·L -1 和10 -3 mol·L -1 . 混合溶液的 哪一个结...
 [方法与规律j] 分类总结电解质溶液图像 作者:化学自习室 来源:未知 日期:2021-10-25 16:31:44 点击:10391 所属专题:电解质溶液图像
[方法与规律j] 分类总结电解质溶液图像 作者:化学自习室 来源:未知 日期:2021-10-25 16:31:44 点击:10391 所属专题:电解质溶液图像
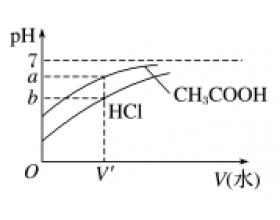
结合图像分析电离平衡、水解平衡、溶解平衡,判断离子浓度的关系是全国卷考查的重点,常考图像类型总结如下: 1.一强一弱溶液的稀释图像 (1)相同体积、相同浓度的盐酸、醋酸 加水稀释相同的倍数,醋酸的pH大 加水稀释到相同的pH,盐酸加入的水多 (2)相同体积、相同pH的...
 [方法与规律j] 酸碱盐溶液中水电离程度大小的比较和计算 作者:化学自习室 来源:未知 日期:2021-09-16 09:05:49 点击:557 所属专题:水电离氢离子浓度
[方法与规律j] 酸碱盐溶液中水电离程度大小的比较和计算 作者:化学自习室 来源:未知 日期:2021-09-16 09:05:49 点击:557 所属专题:水电离氢离子浓度
...
 [方法与规律j] 如何比较强碱弱酸酸式盐溶液中的离子浓度大小? 作者:化学自习室 来源:未知 日期:2021-09-14 07:42:01 点击:2086 所属专题:离子浓度大小比较
[方法与规律j] 如何比较强碱弱酸酸式盐溶液中的离子浓度大小? 作者:化学自习室 来源:未知 日期:2021-09-14 07:42:01 点击:2086 所属专题:离子浓度大小比较
在高中化学教学中,溶液中离子浓度大小的比较是一个重要知识点。对 于强碱弱酸酸式盐NaHA溶液中离子浓度大小的比较更是学生学习和教师教学的难点。而且离子浓度的大小顺序还存在不同的观点: (1)金建忠:电离超过水解的强碱弱酸盐NaHA溶液,只要浓度不太稀, 其离子浓度顺序...
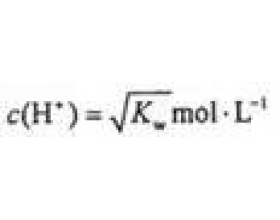 [方法与规律j] 酸、碱溶液等体积混合后溶液pH的定性分析 作者:化学自习室 来源:未知 日期:2022-08-03 16:08:33 点击:1214 所属专题:酸碱中和
[方法与规律j] 酸、碱溶液等体积混合后溶液pH的定性分析 作者:化学自习室 来源:未知 日期:2022-08-03 16:08:33 点击:1214 所属专题:酸碱中和
【问题】 室温时,下列溶液等体积混合后,溶液pH是大于7、小于7、等于7、还是无法判断? ①0.1 mol·L -1 的盐酸溶液和pH=13的氢氧化钡溶液 ②0.1 mol·L -1 的硫酸溶液和pH=13的氢氧化钠溶液 ③pH=1的盐酸溶液和0.1 mol·L -1 的氨水溶液 ④pH=1的硫酸和0.1 mol·L ...
 [方法与规律j] 强酸制弱酸的原理及其应用 作者:化学自习室 来源:未知 日期:2021-03-29 10:52:36 点击:19542 所属专题:强酸制弱酸
[方法与规律j] 强酸制弱酸的原理及其应用 作者:化学自习室 来源:未知 日期:2021-03-29 10:52:36 点击:19542 所属专题:强酸制弱酸
在中学化学中,我们经常听到这样的一种说法强酸制弱酸。那么强酸制弱酸到底是什么原理呢?怎么用? 我们先来看一道题,向氯化钡溶液中通入二氧化硫,会有白色沉淀产生吗?有相当多的一部分同学会认为发生如下反应:SO 2 +H 2 O+BaCl 2 =BaSO 3 ↓+2HCl 很多同学觉得这个...
 [方法与规律j] 常用电离平衡常数的解题技巧 作者:化学自习室 来源:未知 日期:2021-03-11 11:11:31 点击:2739 所属专题:电离平衡常数
[方法与规律j] 常用电离平衡常数的解题技巧 作者:化学自习室 来源:未知 日期:2021-03-11 11:11:31 点击:2739 所属专题:电离平衡常数
电离平衡常数是高考中一个重要的必考考点,常考查电离平衡常数的计算、弱酸的相对强弱、离子浓度离子大小的比较、离子方程式的书写等,大多结合图像进行分析。解决此类问题的关键是,掌握电离常数的概念及基本的计算方法,利用平衡移动原理,认真分析图像的变化趋势,结...
 [方法与规律j] 突破高考化学水溶液中离子平衡的对数图像题 作者:化学自习室 来源:未知 日期:2021-02-23 12:54:43 点击:1087 所属专题:对数曲线
[方法与规律j] 突破高考化学水溶液中离子平衡的对数图像题 作者:化学自习室 来源:未知 日期:2021-02-23 12:54:43 点击:1087 所属专题:对数曲线
1.对数图像的含义。 将溶液中某一微粒的浓度[如c(A)]或某些微粒浓度的比值 取常用对数,即lgc(A)或 ,与溶液中的pH或溶液的体积等关系作出的图像称为对数图像。 图像中数据的的含义为: 2.常考对数图像的类型 例如,有关沉淀溶解平衡的对数图像分析如下: 3.高考真题...
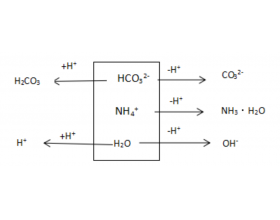 [方法与规律j] 质子守恒三种思维模型 作者:化学自习室 来源:未知 日期:2021-01-19 16:22:34 点击:1407 所属专题:质子守恒
[方法与规律j] 质子守恒三种思维模型 作者:化学自习室 来源:未知 日期:2021-01-19 16:22:34 点击:1407 所属专题:质子守恒
所谓质子守恒式的本质,是指在水溶液中,酸碱盐组分离子(包括水分子),在电离和离子反应过程中,可能会发生质子转移,也就是H + 的转移。这样,必有一方为质子接受体,一方为质子给予体,而质子给予体提供的质子总数等于质子接受体接受的质子总数。这便是质子守恒式子...
 [方法与规律j] 高考化学中四大滴定的基本原理与应用 作者:化学自习室 来源:未知 日期:2020-12-15 09:35:00 点击:2289 所属专题:滴定法
[方法与规律j] 高考化学中四大滴定的基本原理与应用 作者:化学自习室 来源:未知 日期:2020-12-15 09:35:00 点击:2289 所属专题:滴定法
四大滴定即:氧化还原滴定,络合滴定,酸碱滴定,沉淀滴定。 四大滴定的区分主要是跟据反应的类型,以及是否便于测定。比如,氧化还原滴定主要用于氧化还原反应,沉淀滴定主要用于反应中产生沉淀的反应,酸碱滴定主要用于酸性物质与碱性物质的反应或者广义上的路易士酸...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。弱酸也可以制备强酸!!! 比如向 CuSO 4 溶液中加入 H 2 S 溶液生成 CuS 黑色沉淀和 ...
氧化还原滴定法: 1.特点: 氧化还原滴定法在药物分析中应用广泛,用于测定具有氧化性...
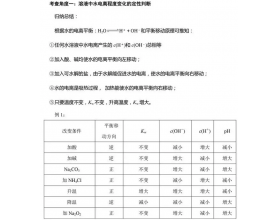
问题1: 在酸溶液中,H + 和OH - 的来源分别是什么?举例说明怎样计算由水电离产生...
电离平衡常数是高考中一个重要的必考考点,常考查电离平衡常数的计算、弱酸的相对强弱...
...
一、原理:影响水的电离平衡因素 H 2 O H + +OH - 1.25 ℃, → c (H + ) H2O = ...
...
电解质溶液中有关离子浓度的判断是近年化学高考的重要题型之一。解此类型题的关键是掌...