
|
学习小专题 |

|
学习小专题 |
 [方法与规律j] 盐和盐的反应规律 作者:马文礼 来源:未知 日期:2016-02-02 20:18:35 点击:11946 所属专题:双水解反应 酸碱盐
[方法与规律j] 盐和盐的反应规律 作者:马文礼 来源:未知 日期:2016-02-02 20:18:35 点击:11946 所属专题:双水解反应 酸碱盐
由于盐的水解及某些盐具有氧化性,还原性,当盐和盐反应时,有下列四种情况: (1)氧化还原反应 当盐和盐反应时,如果有一种盐是氧化剂,另一种盐是还原剂,则发生的是氧化还原反应,例如: 2FeCl 3 +Na 2 S=2FeCl 2 +2NaCl+S↓ 2FeCl 3 +2KI=2FeCl 2 +2KCl+I 2 (2)...
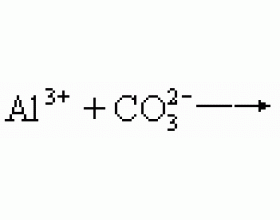 [方法与规律j] 一种配平水解反应方程式的简便方法 作者:童建军 来源:未知 日期:2012-05-16 09:38:58 点击:10556 所属专题:盐类水解方程式
[方法与规律j] 一种配平水解反应方程式的简便方法 作者:童建军 来源:未知 日期:2012-05-16 09:38:58 点击:10556 所属专题:盐类水解方程式
对于水解盐间反应式的配平,不少中学生感到困难.这是由于一部分同学对水解原理理解不清,不知写什么,怎么写;另一部分同学虽然理解了水解原理,但方法欠妥,结果反应式没有写对;还有不少同学是模仿分步化学反应方程式的写法,即先写出各种盐的离子水解的反应式,然后将各...
 [方法与规律j] 怎样利用溶度积来判断沉淀的生成和溶解? 作者:李浩 来源:未知 日期:2019-06-11 16:33:00 点击:15903 所属专题:溶度积 沉淀转化
[方法与规律j] 怎样利用溶度积来判断沉淀的生成和溶解? 作者:李浩 来源:未知 日期:2019-06-11 16:33:00 点击:15903 所属专题:溶度积 沉淀转化
难溶电解质的沉淀和溶解是化学实验和化工生产中经常遇到的过程。例如氯化物在水溶液中同硝酸银反应,生成氯化银沉淀。 NaCl+AgNO 3 ===AgCl↓+NaNO 3 虽然AgCl的溶解度很小,但微溶在水中的AgCl全部电离成Ag + 和Cl - 。在一定温度下,Ag + 和Cl - 与AgCl固体之间,处于...
 [方法与规律j] 常见pH计算的关键 作者:刘玉林 来源:未知 日期:2016-02-02 19:49:28 点击:7053 所属专题:ph计算
[方法与规律j] 常见pH计算的关键 作者:刘玉林 来源:未知 日期:2016-02-02 19:49:28 点击:7053 所属专题:ph计算
一、强酸稀释 关键:必须抓H + ;当酸电离出的H + 很少时,H 2 O的电离不可忽略。 例 1. 将pH=3的盐酸溶液稀释100倍、10 5 倍后其pH各变为多少? 解析: 原溶液中[H+]=1×10 -3 mol/L。 稀释:100倍后,抓H+可知[H + ]=1×10 -3 ÷100=1×10 -5 mol/L,能得出正确结果p...
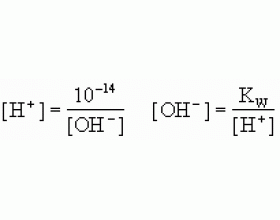 [方法与规律j] 有关pH的计算公式有哪些 作者:单莹 来源:未知 日期:2020-02-28 15:09:32 点击:26835 所属专题:ph计算 计算公式
[方法与规律j] 有关pH的计算公式有哪些 作者:单莹 来源:未知 日期:2020-02-28 15:09:32 点击:26835 所属专题:ph计算 计算公式
(1)pH= -lg[H + ];[H + ]=10 -pH (2)pOH= -lg[OH - ];[OH - ]=10 -pOH (3)K W =[H + ]·[OH - ]=1×10 -14 (4)pH+pOH=14 (5)pH=-lg[H + ]= -lg(m×10 -n )=n-lgm (注意:不指明温度时,温度为常温25℃) 下表是常用到的几个lg值:...
 [方法与规律j] 细说溶度积常数与应用 作者:耿艳 来源:未知 日期:2016-02-02 20:28:36 点击:29260 所属专题:溶度积
[方法与规律j] 细说溶度积常数与应用 作者:耿艳 来源:未知 日期:2016-02-02 20:28:36 点击:29260 所属专题:溶度积
一、沉淀溶解平衡中的常数( K sp )——溶度积 1. 定义:在一定温度下,难溶电解质的饱和溶液中,存在沉淀溶解平衡,其平衡常数叫做溶度积常数(或溶度积) 2. 表示方法:以 M m A n (s) mM n+ (aq) + nA m - (aq)为例(固体物质不列入平衡常数), K sp =[c(M n+ )]...
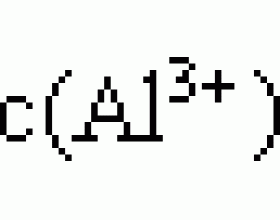 [方法与规律j] 溶液电中性规律的应用 作者:董啸 来源:未知 日期:2016-02-02 20:36:18 点击:6762 所属专题:电荷守恒
[方法与规律j] 溶液电中性规律的应用 作者:董啸 来源:未知 日期:2016-02-02 20:36:18 点击:6762 所属专题:电荷守恒
一、计算离子的物质的量浓度 例1 (2006年全国卷)由硫酸钾、硫酸铝和硫酸组成的混合溶液,其pH=1, = , ,则 为( ) A. 0.15 B. 0.2 C. 0.3 D. 0.4 解析: 本题考查了溶液的电中性规律。由pH=1,得 , = ,因为电解质溶液中阳离子所带正电荷总数与阴离子所带负电荷总...
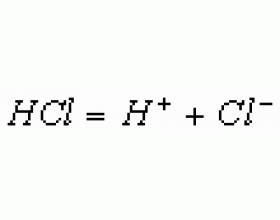 [方法与规律j] 水的离子积在不同溶液中的表示方法及运用 作者:胡长胜 来源:未知 日期:2012-03-26 22:52:49 点击:15113 所属专题:水的离子积常数
[方法与规律j] 水的离子积在不同溶液中的表示方法及运用 作者:胡长胜 来源:未知 日期:2012-03-26 22:52:49 点击:15113 所属专题:水的离子积常数
一、水的离子积在不同溶液中的表示方法 1. 酸中:如盐酸,在盐酸中存在 、H 2 O , 由酸和水电离产生,但由水电离产生的 远远小于由酸电离产生的 ,因此 。 所以 。 2. 碱中:如NaOH,NaOH= 、 , 由碱和水电离产生,但由水电离产生的 远远小于由碱电离产生的 ,因此 + 。...
 [方法与规律j] 酸碱中和后pH判断 作者:单莹 来源:未知 日期:2016-03-09 21:42:01 点击:14441 所属专题:酸碱中和 酸碱性判断
[方法与规律j] 酸碱中和后pH判断 作者:单莹 来源:未知 日期:2016-03-09 21:42:01 点击:14441 所属专题:酸碱中和 酸碱性判断
题目: 常温下, pH=2的 溶液与pH=12的 NaOH 溶液等体积混合(设混合液总体积为两溶液体积之和,下同)后,溶液的pH为( ); 常温下,0.01mol/L的 溶液与0.01mol/L的 NaOH 溶液等体积混合后,溶液的pH为( ) A. pH7 B. pH7 C. pH=7 D. 无法确定 解析: 常温下, pH=2...
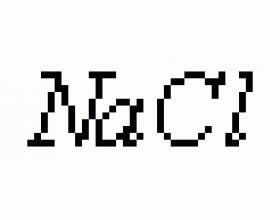 [方法与规律j] 盐溶液中的三大守恒 作者:王欣华 来源:未知 日期:2020-03-03 11:49:11 点击:10754 所属专题:三大守恒
[方法与规律j] 盐溶液中的三大守恒 作者:王欣华 来源:未知 日期:2020-03-03 11:49:11 点击:10754 所属专题:三大守恒
一、三个守恒的建立 在盐溶液中,均存在两个物料守恒(即从水的电离和盐的电离两个角度,根据变化前后原子个数建立的守恒)和一个电荷守恒(即阴、阳离子所带的电荷总数相等)。那么这三个守恒是如何建立的呢?可分以下几种情况讨论: 1. 强酸强碱盐溶液 以 溶液为例来...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。弱酸也可以制备强酸!!! 比如向 CuSO 4 溶液中加入 H 2 S 溶液生成 CuS 黑色沉淀和 ...
氧化还原滴定法: 1.特点: 氧化还原滴定法在药物分析中应用广泛,用于测定具有氧化性...
问题1: 在酸溶液中,H + 和OH - 的来源分别是什么?举例说明怎样计算由水电离产生...
电离平衡常数是高考中一个重要的必考考点,常考查电离平衡常数的计算、弱酸的相对强弱...
...
一、原理:影响水的电离平衡因素 H 2 O H + +OH - 1.25 ℃, → c (H + ) H2O = ...
...
电解质溶液中有关离子浓度的判断是近年化学高考的重要题型之一。解此类型题的关键是掌...