
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
无论是单一液质的溶液,还是混合溶液;无论是稀溶液,还是浓溶液,其电解质溶液一定呈电中性,这是电解质溶液的一个基本性质。如果能善于利于这一性质,对解决一些溶液中的问题会带来很大的帮助,现举几例说明:
1.进行溶液中离子浓度的比较
例1.常温下氨水与盐酸的混合液液中,NH4+与Cl-的物质的量浓度相等,则混合溶液的pH值为( )
A. 大于是7 B. 小于
解析:溶液中的pH由溶液中[H+]决定,在氨水和盐酸的混合溶液中,仅有4种离子:NH4+ 、Cl-、OH-、H+。根据电解质溶液量电中性的原理:
[H+]+[NH4+]=[Cl-]+[OH-],由题设条件知[NH4+]=[Cl-],则[H+]=OH-],故pH=7。
本题答案为:C
2.判断溶液中离子存在的情况
例2. 某溶液A只含有NH4+、Na+、Mg2+、Al3+、CO32-、SO42-中的几种,若取A溶液加入Na2O2粉末,有无色无味的气体放出,并生成白色沉淀,加入Na2O2的量为X,生成沉淀的量为Y,则有如右图所示关系,可知:
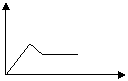
(1)A中一定有__________离子
(2 ) A中一定没有___________离子
(3 ) A中可能有_____________离子
解析:加入Na2O2粉末,放出有无色无味的气体,说明溶液中不含NH4+;有白色沉淀生成,说明一定有Mg2+、Al3+中的一种或二种;CO32- 会同Mg2+、Al3+发生反应,说明一定没有CO32-;根据加入Na2O2的量与生成沉淀量的图所示关系,可知溶液a中一定有Mg2+、Al3+。这样溶液a中现可以肯定的是:一定有Mg2+、Al3+,一定没有NH4+、CO32-。Na+和SO42-从实验现象还不能确定是否存在,但根据溶液呈电中性的原理,a溶液中一定存在SO42-。
本题的答案为:(1):Mg2+、Al3+、SO42- (2):NH4+、CO32-(3):Na+
3.用于溶液中有关离子浓度的计算
例3.某酸性溶液经测定含有Na+、Cl-、SO42-和Al3+其浓度依次为:0.04mol/L,0.02mol/L,0.03mol/L,0.013mol/L。求此溶液的pH值.
解析:求溶液的pH值,首先必须求出溶液中[H+]或[OH-]。根据题给条件,溶液中阴离子所带负电荷为:0.02+0.03×2=0.08 mol/L。阳离子所带正电荷为:0.04+0.013×3=0.079 mol/L,根据溶液呈电中性原理可知:[H+]=0.001 mol/L,溶液呈酸性,pH=3。
练习:
1.关于0.1 mol/L 的 Na2CO3 溶液,下列离子浓度的比较不正确的是:
[A]、[Na+]=2([CO32-]+[HCO3-]+[H2CO3])
[B]、[Na+]+[H+]=[HCO3-]+2[CO32-]+[OH-]
[C]、[Na+]+[H+]=[HCO3-]+[CO32-]+[OH-]
[D]、[OH-]=[H+]+[CO32-]+2[H2CO3]
2.有甲乙两相邻的工厂,排放污水经初步处理后只溶有:Ag+、Ba2+、Fe3+、Na+、SO42-、NO3-、Cl-、OH-中的各不相同的四种离子,若单独排放仍会造成环境污染,如将两厂的污水按适当比例混合,沉淀后,污水转变为无色澄清的NaNO3溶液排出,则污染程度大为降低,现又测得甲厂的污水pH>7,试推断:
(1)甲厂污水中含有四种离子为_________________
(2)乙厂污水中含有四种离子为_________________
3.在硫酸铝、硫酸钾和明矾的混合溶液中, SO42-离子浓度为0.20 mol/L,加入等体积0.20 mol/L 的KOH溶液时,生成的白色沉淀又可恰好溶解,那么,原溶液中的K+浓度是下列中的( )
答案:1、C 2、(1)Na+、SO42-、OH- 、Cl-(2)Ag+、Fe3+、Ba2+、NO3-

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。弱酸也可以制备强酸!!! 比如向 CuSO 4 溶液中加入 H 2 S 溶液生成 CuS 黑色沉淀和 ...
氧化还原滴定法: 1.特点: 氧化还原滴定法在药物分析中应用广泛,用于测定具有氧化性...
问题1: 在酸溶液中,H + 和OH - 的来源分别是什么?举例说明怎样计算由水电离产生...
电离平衡常数是高考中一个重要的必考考点,常考查电离平衡常数的计算、弱酸的相对强弱...
...
一、原理:影响水的电离平衡因素 H 2 O H + +OH - 1.25 ℃, → c (H + ) H2O = ...