
|
学习小专题 |

|
学习小专题 |
 [注解与辨疑a] 原子半径规律解读 作者:何永成 来源:未知 日期:2015-04-03 11:21:17 点击:10705 所属专题:半径比较
[注解与辨疑a] 原子半径规律解读 作者:何永成 来源:未知 日期:2015-04-03 11:21:17 点击:10705 所属专题:半径比较
课本中给出的原子半径数据除稀有气体元素外,均为共价半径,稀有气体原子半径是范氏半径。所以比较原子半径时一般排除稀有气体元素。 中学范围内一般可用如下方法来比较微粒半径的大小: (1)三看,不在乎是离子还是原子: 一看电子层数:电子层数越多半径越大:例如Na>Li,...
 [注解与辨疑a] 任何离子键在形成的过程中必定有电子的得失吗? 作者:鲁志超 来源:未知 日期:2015-02-01 15:32:30 点击:1464 所属专题:离子键
[注解与辨疑a] 任何离子键在形成的过程中必定有电子的得失吗? 作者:鲁志超 来源:未知 日期:2015-02-01 15:32:30 点击:1464 所属专题:离子键
错。 例如:氯化钡跟硫酸钠反应这种类型。形成硫酸钡或氯化钠没有电子得失。...
 [注解与辨疑a] 元素周期律知识相关概念的辨析 作者:周书峰 来源:未知 日期:2016-01-24 16:59:07 点击:1821 所属专题:概念辨析 元素周期律
[注解与辨疑a] 元素周期律知识相关概念的辨析 作者:周书峰 来源:未知 日期:2016-01-24 16:59:07 点击:1821 所属专题:概念辨析 元素周期律
(1)元素金属性非金属性概念 元素的金属性,指的是金属气态原子失去电子能力的性质。元素金属性的强弱可以由元素的原子电离能来衡量。元素的原子电离能指的是在多电子的原子中,处于基态的气态原子失去电子形成气态阳离子时,所需要吸收的能量。我们通常说的电离能,一般...
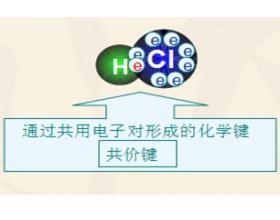 [注解与辨疑a] 共价键与离子键辨析 作者:王绍红 来源:未知 日期:2014-12-06 19:48:28 点击:7115 所属专题:共价键 离子键
[注解与辨疑a] 共价键与离子键辨析 作者:王绍红 来源:未知 日期:2014-12-06 19:48:28 点击:7115 所属专题:共价键 离子键
离子键与共价键的区别 1、离子键和共价键定义不同 阴、阳离子间的静电作用叫做离子键。原子间通过共用电子对形成的相互作用叫共价键。 2、离子键和共价键组成元素不同 离子键一般由活泼金属和活泼非金属组成,共价键由非金属与非金属组成,或非金属性较弱的元素与金属性较弱...
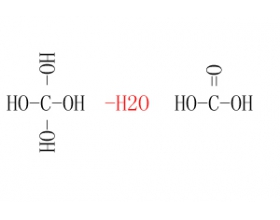 [注解与辨疑a] 元素最高价氧化物对应水化物的写法 作者:张红 来源:未知 日期:2014-12-06 19:05:00 点击:63681 所属专题:最高价氧化物水化物
[注解与辨疑a] 元素最高价氧化物对应水化物的写法 作者:张红 来源:未知 日期:2014-12-06 19:05:00 点击:63681 所属专题:最高价氧化物水化物
元素最高价氧化物对应的水化物,这一概念出现在高中化学必修2元素周期律那章,用于判断元素金属性和非金属性强弱。元素最高价氧化物对应水化物碱性越强,则金属性越强;元素最高价氧化物对应水化物酸性越强,则非金属性越强。 有些同学对于元素最高价氧化物对应的水化物...
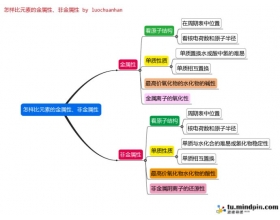 [注解与辨疑a] 怎样比较金属性、非金属性的强弱之思维导图 作者:张安荣 来源:未知 日期:2016-01-22 18:53:51 点击:1897 所属专题:金属性 非金属性
[注解与辨疑a] 怎样比较金属性、非金属性的强弱之思维导图 作者:张安荣 来源:未知 日期:2016-01-22 18:53:51 点击:1897 所属专题:金属性 非金属性
...
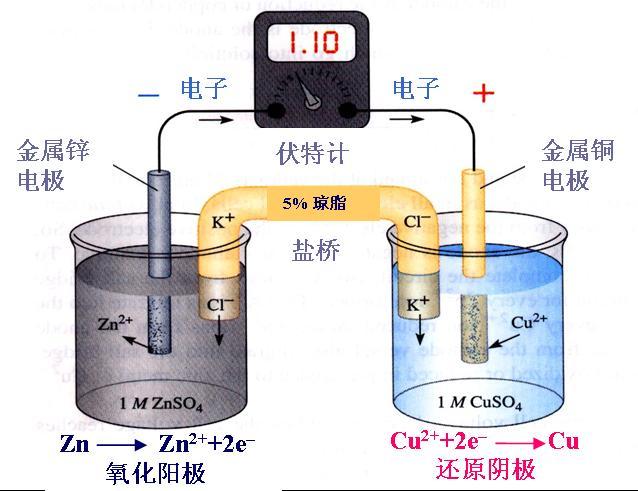 [注解与辨疑a] 金属性和金属活动性概念比较 作者:邵磊 来源:未知 日期:2014-09-24 09:34:38 点击:1443 所属专题:金属性 金属活动性
[注解与辨疑a] 金属性和金属活动性概念比较 作者:邵磊 来源:未知 日期:2014-09-24 09:34:38 点击:1443 所属专题:金属性 金属活动性
元素的金属性指的是元素原子的性质,是元素的气态原子失去电子变成气态阳离子倾向的大...
 [注解与辨疑a] 物质结构(必修)易错判断 作者:许雁祥 来源:未知 日期:2016-01-22 19:01:12 点击:729 所属专题:物质结构必修 是非判断
[注解与辨疑a] 物质结构(必修)易错判断 作者:许雁祥 来源:未知 日期:2016-01-22 19:01:12 点击:729 所属专题:物质结构必修 是非判断
( )1. 16 O 2 与 18 O 2 互为同位素,它们的性质基本相同。 ( )2. 第三周期元素的简单离子半径随原手序数的递增依次减...
 [注解与辨疑a] 氢的同位素的介绍 作者:舒次恩 来源:未知 日期:2021-05-07 08:51:54 点击:20260 所属专题:同位素
[注解与辨疑a] 氢的同位素的介绍 作者:舒次恩 来源:未知 日期:2021-05-07 08:51:54 点击:20260 所属专题:同位素
首先,我们来看看同位素的定义。同位素的定义如下:具有相同质子数和不同中子数的原子互称为同位素。 氢有三种同位素,即氕(读音:piē)、氘 (读音:dāo)、氚 (读音:chuān)。 氕〈读音〉piē,原子质量为1的普通的轻氢同位素。元素符号为 1 H,通常称为氢,它是氢的...
 [注解与辨疑a] 物质结构(必修)6类29条误区归纳 作者:赵宝 来源:未知 日期:2016-01-08 15:09:35 点击:3828 所属专题:物质结构必修
[注解与辨疑a] 物质结构(必修)6类29条误区归纳 作者:赵宝 来源:未知 日期:2016-01-08 15:09:35 点击:3828 所属专题:物质结构必修
1 、原子结构 ( 1 )所有元素的原子核都由质子和中子构成。 正例: 12 C 、 13 C 、 14 C 三原子质子数相同都是 6 ,中子数不同,分别为 6 、 7 、 8 。 反例 1 :只有氕( H )原子中没有中子,中子数为 0 。 ( 2 )所有原子的中子数都大于质子数。 正例 1 : C 、 C...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。人教版高中化学必修第一册2019年6月第1版2024年7月第8次印刷P 10 3 讲解卤素单质与氢...
冰在0℃开始融化。这是本家都熟悉的事儿。 然而,世界上竟有热冰它在3.8℃方才融化! ...
1. 为什么 HF 分子间氢键比 H 2 O 分子间氢键强,而 HF 的沸点却比 H 2 O 的低? 由于...
1、为什么氧、氟没有最高正价?(朱朝宇) 氟是非金属性最强的元素,理论上没有哪种物...
1.如何理解分子间作用力的本质也是静电作用? 首先,在极性分子与极性分子之间,存在...
【关于化学键(Chemical bond)】: 化学键(Chemical bond)实质上是电性的微观作用...
...
准金属(metalloid),又称为半金属(semimetal),介于金属和非金属之间的物质。准金...