
|
学习小专题 |

|
学习小专题 |
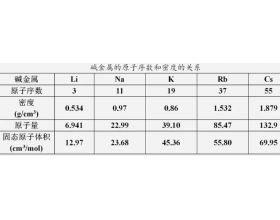 [注解与辨疑a] 元素周期表疑难问题集 作者:小虫化学之路 来源:未知 日期:2020-03-12 17:23:32 点击:4257 所属专题:元素周期表
[注解与辨疑a] 元素周期表疑难问题集 作者:小虫化学之路 来源:未知 日期:2020-03-12 17:23:32 点击:4257 所属专题:元素周期表
基础篇 1、现代元素周期表是按照相对原子质量的大小编排的吗? 不是。门捷列夫发表的元素周期表是按照相对原子质量排序的,这也成为困扰了他一生的题—他的元素周期表出现了个别元素“相对原子质量颠倒”的现象。现代元素周期表排序已经更正为原子序数(在数值上等于核电...
 [注解与辨疑a] 最全化学元素周期表读音及性质 作者:化学自习室 来源:未知 日期:2021-12-29 14:11:52 点击:11924 所属专题:元素周期表结构 元素读音
[注解与辨疑a] 最全化学元素周期表读音及性质 作者:化学自习室 来源:未知 日期:2021-12-29 14:11:52 点击:11924 所属专题:元素周期表结构 元素读音
1氢(qīng) 2氦(hài) 3锂(lǐ) 4铍(pí) 5硼(péng) 6碳(tàn) 7氮(dàn) 8氧(yǎng) 9氟(fú) 10氖(nǎi) 11钠(nà) 12镁(měi) 13铝(lǚ) 14硅(guī) 15磷(lín) 16硫(liú) 17氯(lǜ) 18氩(yà) 19钾(jiǎ) 20钙(gài) 21钪(kàng) 22钛(tài) 23钒(fán) 24铬(gè)...
 [注解与辨疑a] 2018版元素周期表图 作者:化学自习室 来源:未知 日期:2020-02-21 21:16:41 点击:7648 所属专题:元素周期表结构
[注解与辨疑a] 2018版元素周期表图 作者:化学自习室 来源:未知 日期:2020-02-21 21:16:41 点击:7648 所属专题:元素周期表结构
...
 [注解与辨疑a] 关于元素周期律(表)的6大误区 作者:化学自习室 来源:未知 日期:2020-02-16 15:31:26 点击:783 所属专题:元素周期律
[注解与辨疑a] 关于元素周期律(表)的6大误区 作者:化学自习室 来源:未知 日期:2020-02-16 15:31:26 点击:783 所属专题:元素周期律
常见误区 出错原因 误认为最高正价和最低负价绝对值相等的元素只有第ⅣA族的元素 忽视了第ⅠA族的H的最高正价为+1,最低负价为-1 误认为主族元素的最高正价一定等于其族序数 忽视了氧元素无最高正价,氟元素无正价 误认为元素的非金属性越强,其氧化物对应水化物的酸性就...
 [注解与辨疑a] 稳定结构一定是8电子结构吗? 作者:化学自习室 来源:未知 日期:2019-11-11 15:55:06 点击:4000 所属专题:8电子结构
[注解与辨疑a] 稳定结构一定是8电子结构吗? 作者:化学自习室 来源:未知 日期:2019-11-11 15:55:06 点击:4000 所属专题:8电子结构
稳定结构一般来说是8电子结构。除此而外,还有其他的电子结构。 (1) 质子结构。在水溶液中H + 离子不能单独存在,而成水合离子H 3 O + 存在。 (2) 过渡元素形成化合物时,最外层的电子数一般是8 —18 个。如Fe 2+ 的最外层是14个电子,Fe 3+ 最外层是13个电子。 (3) 非...
 [注解与辨疑a] 关于氧化性、还原性和金属性、非金属性的辨析 作者:胡月明 来源:未知 日期:2019-10-31 09:18:11 点击:3027 所属专题:氧化性 还原性 金属性 非金属性
[注解与辨疑a] 关于氧化性、还原性和金属性、非金属性的辨析 作者:胡月明 来源:未知 日期:2019-10-31 09:18:11 点击:3027 所属专题:氧化性 还原性 金属性 非金属性
氧化性与还原性,以及非金属性与金属性是两组重要的概念,在中学化学中,这两组概念的均是从得失电子的角度去理解。 氧化性、还原性是指物质(单质和化合物)得失电子的能力,而非金属性与金属性则是指元素的原子得失电子的能力,原子得电子的能力体现其所属元素的非金属性...
 [注解与辨疑a] 怎样区分元素金属性与金属活动性、元素的非金属性与非金属单质的 作者:化学自习室 来源:未知 日期:2019-10-31 08:59:00 点击:2142 所属专题:金属性 金属活动性 非金属性
[注解与辨疑a] 怎样区分元素金属性与金属活动性、元素的非金属性与非金属单质的 作者:化学自习室 来源:未知 日期:2019-10-31 08:59:00 点击:2142 所属专题:金属性 金属活动性 非金属性
元素的金属性和非金属性的有关知识是中学化学教学中元素周期律部分的重要知识之一,正确理解和掌握其判断方法对于学好化学具有很大的帮助,下面对元素的金属性和非金属性的有关问题做一总结分析. 一、金属性、非金属性与元素性质间的关系 元素的性质包括元素的原子半径、核...
 [注解与辨疑a] 电子层数越多的元素的原子半径一定越大吗? 作者:龙阜 来源:未知 日期:2019-06-05 10:14:46 点击:2537 所属专题:半径比较
[注解与辨疑a] 电子层数越多的元素的原子半径一定越大吗? 作者:龙阜 来源:未知 日期:2019-06-05 10:14:46 点击:2537 所属专题:半径比较
是否电子的能层数多的元素的原子半径一定大于电子的能层数少的元素的原子半径? 答:不一定。原子半径大小由核电荷数与电子的能层数两个因素共同决定的,例如碱金属元素的原子半径比它下一周期卤素原子半径大。...
 [注解与辨疑a] 铵盐中无离子键! 作者:李先军 来源:未知 日期:2018-11-15 22:21:23 点击:2201 所属专题:离子键
[注解与辨疑a] 铵盐中无离子键! 作者:李先军 来源:未知 日期:2018-11-15 22:21:23 点击:2201 所属专题:离子键
两种元素电负性相差大于1.7时,二者之间通过离子键结合。当二者电负性相差小于1.7时,二者通过共价键结合。那么等于1.7呢?当二者电负性相同时,共用电子对不偏,此时叫非极性键;如果二者电负性不同,共用电子对就会偏向电负性大的一方,此时称之为极性键;当共用电子对强...
 [注解与辨疑a] 金属性和金属活泼性 作者:张劲辉 来源:未知 日期:2018-08-14 16:43:24 点击:5707 所属专题:金属性 金属活动顺序表
[注解与辨疑a] 金属性和金属活泼性 作者:张劲辉 来源:未知 日期:2018-08-14 16:43:24 点击:5707 所属专题:金属性 金属活动顺序表
1金属性和金属活泼性 元素的金属性通常是指元素的气态原子失去电子的能力。非金属性则是指元素的气态原子获得电子的能力。而元素的原子失去电子或获得电子的能力都是相对的,因此,元素的金属性和非金属性也是相对的。元素的气态原子失去电子的倾向通常用电离能来衡量。电离...
 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。人教版高中化学必修第一册2019年6月第1版2024年7月第8次印刷P 10 3 讲解卤素单质与氢...
冰在0℃开始融化。这是本家都熟悉的事儿。 然而,世界上竟有热冰它在3.8℃方才融化! ...
1. 为什么 HF 分子间氢键比 H 2 O 分子间氢键强,而 HF 的沸点却比 H 2 O 的低? 由于...
1、为什么氧、氟没有最高正价?(朱朝宇) 氟是非金属性最强的元素,理论上没有哪种物...
1.如何理解分子间作用力的本质也是静电作用? 首先,在极性分子与极性分子之间,存在...
【关于化学键(Chemical bond)】: 化学键(Chemical bond)实质上是电性的微观作用...
...
准金属(metalloid),又称为半金属(semimetal),介于金属和非金属之间的物质。准金...