
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、构成原电池的条件
解题要领:形成原电池的条件是
即要形成原电池必须同时满足(1)、(2)、(3)三个条件.
[例1]下列装置能够构成原电池产生电流的是 [ ]
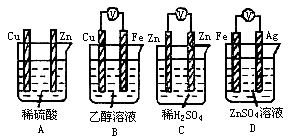
[解析]A只满足条件(1)、(2),但不满足条件(3);B只满足条件(1);C只满足条件(2);D同时满足条件(1)、(2)、(3).通过分析,正确答案应选D.
二、确定原电池电极名称
解题要领:
方法一,根据原电池电极材料的性质确定.通常是
1、对于金属──金属电极,活泼金属是负极,不活泼金属是正极.
2、对于金属──非金属电极,金属是负极,非金属是正极,如干电池等.
3、对于金属──化合物电极,金属是负极,化合物是正极,如![]()
方法二,根据电极反应的本质确定:原电池中,负极向外电路提供电子,所以负极上一定发生失电子的氧化反应,正极上则一定发生得电子的还原反应.所以,失电子的反应→氧化反应→负极;得电子的反应→还原反应→正极.
[例2]银锌电池广泛用作各种电子仪器的电源,它的充电和放电过程可以表示为:
![]()
在此电池放电时,负极上发生反应的物质是 [ ]
A.Ag B.Zn(OH)2 C.Ag2O D.Zn
[解析]电池放电时,发生的反应为Ag2O + Zn + H2O→2Ag+Zn(OH)2,在此氧化还原反应中zn元素的化合价变化为0→+2,Zn失去电子,由方法二可判断出此电池放电时,负极上发生反应的物质是Zn,故答案选D。
三、确定电解(镀)池电极名称
解题要领:确定电解(镀)池电极名称有如下两种方法.方法一,与外电源正极连接的一极是阳极,与负极连接的一极是阴极.方法二,电极上发生氧化反应的是阳极,发生还原反应的是阴极.
[例3]某种蓄电池的充放电过程可表示为:
![]()
该电池充电时阳极是,______,阴极是______.
四、分析电极反应及其产物
解题要领:对于原电池的电极反应,负极是金属,失去电子发生氧化反应;正极是溶液中的阳离子,得电子发生还原反应.对于电解(镀)池的电极反应,情况较为复杂.首先,要分析阳极材料的性质.若阳极是由活性材料(除C、Rt、Au等以外的其它金属)做成,阳极反应是阳极金属失去电子被氧化成阳离子;若阳极是由C、Pt、Au等情性材料做成,阳极反应则是电解液中的阴离子在阳极失去电子被氧化.阴离子失电子能力大小顺序为:I->Br->Cl->OH->含氧酸根>F-.其次,要分析阴极.阴极反应一般是溶液中的阳离子得电子的还原反应,阳离子得电子能力大小顺序:Ag+>Hg2+>Fe3+>Cu2+>H+>Pb2+>Fe2+>Zn2+>Al3+>Mg2+>Na+>Ca2+>K+.必须注意的是,电镀时通过控制条件,Fe2+和Zn2+得电子的能力强于H+.
[例4]右图中X、Y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无臭气体放出,符合这一情况的是 [ ]
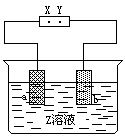
[解析]a极板质量增加,说明a极附近金属阳离子放电,在a极板析出,故a极板为阴极,阴极接电源的负极,故X为负极,则溶液中的阳离子为Ag+或Cu2+,淘汰选项B、C.b极处有无色无臭气体放出,则放电的阴离子为OH-,因而排除D.故正确答案选A.
五、原电池、电解池工作后pH变化
解题要领:电解后引起溶液pH增大的情况为①电解活泼金属的无氧酸盐及无氧酸的溶液,H+放电,OH-不放电.②电解强碱溶液,H+和OH-均放电,相当于电解水,碱的浓度变大.③电解不活泼金属的无氧酸盐溶液(如CuCl2)时,就是它们本身被电解(氟化物除外),当CuCl2完全电解后,酸性溶液变成中性的水.电解后引起溶液pH减小的情况为①电解含氧酸溶液,OH-和H+均放电,相当于电解水,酸的浓度变大.②电解不活泼金属含氧酸盐溶液,OH-放电,H+浓度增大.电解后溶液pH不变的情况只有电解活泼金属的含氧酸盐溶液.
[例5]用石墨作电极,电解1mol/L下列物质的溶液,溶液的pH保持不变的是 [ ]
A.HCl B.NaOH C.Na2SO4 D.NaCl
[解析]A为无氧酸溶液,电解后溶液的pH增大.B为强碱溶液,电解后溶液的pH增大.C为活泼金属的含氧酸盐溶液,电解后溶液的pH保持不变.D为活泼金属的无氧酸盐溶液,电解后溶液的pH增大.故正确答案选C.
六.金属活动性大小与金属腐蚀的快慢
解题要领:在原电池中总是活泼金属作为负极,较不活泼金属作正极.在电解池中,更不活泼金属的阳离子在阴极先放电.在同一电解质溶液中,金属腐蚀的快慢可用下列原则判断:电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防腐措施的腐蚀.
[例6]X、Y、Z、M代表四种金属.金属X和Z用导线连接放入稀H2SO4中时,X溶解,Z极上有H2放出;若电解Y2+离子和Z2+离子共存的溶液时,Y先析出;又知M2+离子的氧化性强于Y2+离子.则这四种金属的活动性由强到弱的顺序为 [ ]
A.X>Z>Y>M B.X>Y>Z>M C.M>Z>X>Y D.X>Z>M>Y
[解析]由原电池的原理可知:金属的活动性X>Z;由电解原理可知:金属的活动性Z>Y;由氧化还原规律可知金属的活动性Y>M.综上所述,四种金属的活动性顺序为X>Z>Y>M,即答案选A.
[例7]下图各容器中盛有海水,铁在其中被腐蚀时,由快到慢的顺序是 [ ]
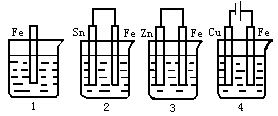
A.4>2>1>3 B.2>1>3>4 C.4>2>3>1 D.3>2>4>1
[解析]在原电池中,活泼金属为负极,该金属被氧化,不活泼金属便被保护起来,其被腐蚀的速率大为减小,所以装置3中的铁被腐蚀的速率比1中的慢;反之,当钢铁与比它不活泼的金属(如Sn、Cu等)联结起来,则其被腐蚀的速率加快,所以在容器2中的铁比容器1中的铁被腐蚀快得多.容器4是一个电解池,在这里Fe是阳极,不断地以Fe2+形式进入海水中,海水中的Fe2+趋向阴极获得电子,以铁原子形式析出,从而加速了铁的腐蚀,故在上述四种容器中,容器4中的Fe被腐蚀得最快.综上所述,Fe被腐蚀的快慢顺序为:4>2>1>3,答案选A.
七、电化学的有关计算
有关原电池、电解池、电镀池工作一段时间后的计算不外乎求各电极上的产量、电解质溶液浓度的变化及pH的变化.有关计算的解题要领是:抓住电解池或串联电池组工作时单位时间内各电极上通过的电量相等,用电子得失守恒找出关系式求解.
[例8]用惰性电极电解某金属硫酸盐溶液时,在阴极上析出ag金属,同时在阳极上析出0.8g气体.如果该金属的相对原子质量为b,则其化合价为 [ ]
[解析]在阳极析出的是氧气,设该金属化合价为x,由电子得失守恒

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
锌溴液流电池是一种大规模储能电池,相比传统铅酸电池锂离子...
电化学是高中化学的重要组成部分,是高考的必考内容,然而,...
电化学原理是普通高中化学选择性必修1化学反应原理中的重要...
一、判断有机物得失电子 例1: 微生物电池是指在微生物的作用...
近几年全国卷高考电化学装置一般都带有离子交换膜,此类题目...
【 知识归纳 】 1. 浓差电池的定义 物质由 高浓度 向 低浓度 扩...