
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
有关可充电电池试题是今年高考一大亮点,这充分说明可充电电池在今后教学中的重要性。但这类试题往往又是学生学习的难点,错误率较高。笔者仔细研究了可充电电池试题,对这类试题解法进行点拨,供同学们复习时参考。
一.解可充电电池试题必备知识
1.对可充电电池充电和放电两过程认识:
放电是原电池反应,充电是电解池反应。要能根据题给总反应式,写出原电池总反应式和电解池总反应式。
2.对可充电电池电极极性和材料的判断:
判断电池放电时电极极性和材料,可先标出放电(原电池)总反应式电子转移的方向和数目,失去电子的一极为负极,该物质即为负极材料;得到电子的一极为正极,该物质即为正极材料。若判断电池充电时电极极性和材料,方法同前,失去电子的一极为阳极,该物质即为阳极材料;得到电子的一极为阴极,该物质即为阴极材料。
3.可充电电池电极反应式的书写方法:
书写可充电电池电极反应式,一般都是先书写放电的电极反应式。书写放电的电极反应式时,一般要遵守三步:第一,先标出原电池总反应式电子转移的方向和数目,指出参与负极和正极反应的物质;第二,写出一个比较容易书写的电极反应式(书写时一定要注意电极产物是否与电解质溶液共存);第三,在电子守恒的基础上,总反应式减去写出的电极反应式即得另一电极反应式。
充电的电极反应与放电的电极反应过程相反,充电的阳极反应为放电正极反应的逆过程,充电的阴极反应为放电负极反应的逆过程。
4.对可充电电池某电极是发生氧化还是还原反应及某元素被氧化还是被还原的判断:
可根据电极反应式进行分析,放电(原电池)的负极及充电(电解池)的阳极均失去电子,发生了氧化反应,其变价元素被氧化;放电(原电池)的正极及充电(电解池)的阴极均得到电子,发生了还原反应,其变价元素被还原。
5.对溶液中离子的移动方向判断:
放电时,阴离子移向负极,阳离子移向正极;充电时,阴离子移向阳极,阳离子移向阴极。
6.可充电电池充电时与电源的连接:
可充电电池用完后充电时,原电池的负极与外电源的负极相连,原电池的正极与外电源的正极相连。
7.有关电化学的计算:
有关电化学的计算都必须利用电子守恒,要注意各电极转移的电子数均相等。这类计算通常有计算电极的增重或较少量、溶液的pH、溶液的离子浓度、电子转移的数目等。
二.可充电电池试题的解题策略
综观历年高考试题可发现,解可充电电池试题的关键在于能否正确书写电极反应式。书写电极反应式的关键是能否正确书写放电时的电极反应式。要正确书写放电时的电极反应式,既要弄清得失电子的物质,还要特别注意电极产物是否与电解质溶液共存,要写出实际存在的电极反应式。然后根据原电池的负极反应与电解池的阳极反应、原电池的正极反应与电解池的阴极反应互为逆反应,即可快速写出充电时的电极反应式。各电极反应式顺利写出以后,即可正确解题。
三.有关可充电电池高考试题题型分析
1.可充电电池电极极性和材料判断
例1(2001年广东化学卷第2题)镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用,它的充放电反应按下式进行:Cd(OH)2+2Ni(OH)2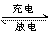 Cd+2NiO(OH)+2H2O。由此可知,该电池放电时的负极材料是( )
Cd+2NiO(OH)+2H2O。由此可知,该电池放电时的负极材料是( )
A.Cd(OH)2 B.Ni(OH)2 C.Cd D.NiO(OH)
解析:要理解镍镉电池放电和充电的过程。放电是原电池反应,根据题给条件知放电(原电池)时的总反应式为:Cd+2NiO(OH)+2H2O→Cd(OH)2+2Ni(OH)2。标出原电池总反应式电子转移的方向和数目指出,即可知道参与负极反应的物质:
从上式可知,Cd可作负极材料,参与负极反应。
故应选C。
点评:此类试题考查可充电电池电极极性和材料判断,首先要准确判断充电、放电分别表示什么反应(原电池反应还是电解池反应),并写出充电、放电的总反应式,然后在总反应式上标出电子转移的方向和数目,即可正确判断可充电电池电极极性和材料。
2.可充电电池电极反应式的书写和判断
例2(05江苏化学卷第14题)高铁电池是一种新型可充电电池,与普通高能电池相比,该电池长时间保持稳定的放电电压。高铁电池的总反应为3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是( )
3Zn(OH)2+2Fe(OH)3+4KOH,下列叙述不正确的是( )
A.放电时负极反应为:Zn-2e-+2OH-=Zn(OH)2
B.充电时阳极反应为:Fe(OH)3-3e-+5OH-=FeO42-+4H2O
C.放电时每转移3mol 电子,正极有1mol K2FeO4被氧化
D.放电时正极附近溶液的碱性增强
解析:高铁电池放电作用是原电池的功能,其总反应式为:3Zn+2K2FeO4+8H2O=3Zn(OH)2+2Fe(OH)3+4KOH,根据上述书写电极反应式的方法可知,负极反应为:Zn-2e-+2OH-=Zn(OH)2,正极反应为:FeO42-+4H2O +3e-= Fe(OH)3+5OH-,a正确;充电就是发生电解池反应,其总反应式为:3Zn(OH)2+2Fe(OH)3+4KOH=3Zn+2K2FeO4+8H2O,根据上述书写电极反应式的方法可知,阳极反应为:Fe(OH)3+5OH--3e-=FeO42-+4H2O,b正确。放电时每转移3mol 电子,正极有1mol K2FeO4被还原为Fe(OH)3,而不是被氧化,C错误。根据正极反应式FeO42-+4H2O +3e-= Fe(OH)3+5OH-知,放电时生成OH-,故正极附近溶液的碱性增强。故本题应选C。
点评:本题主要考查电极反应式的书写、电解质溶液的酸碱性变化、及氧化还原反应等知识,侧重考查考生对原电池和电解池原理的理解及分析问题的能力。
3.可充电电池电极发生氧化、还原反应及元素被氧化、被还原判断
例3(2006年广东化学卷第16题)某可充电的锂离子电池以LiMn2O4为正极,嵌入锂的碳材料为负极,含Li+导电固体为电解质。放电时的电池反应为:Li+LiMn2O4=Li2Mn2O4。下列说法正确的是( )
A.放电时,LiMn2O4发生氧化反应
B.放电时,正极反应为:Li++LiMn2O4+e-=Li2Mn2O4
C.充电时,LiMn2O4发生氧化反应
D.充电时,阳极反应为:Li++e-=Li
解析:放电时作为电源来用,根据放电时的电池反应知,负极反应式为:Li-e-=Li+,正极反应式为:Li++LiMn2O4+e-=Li2Mn2O4,b正确,但LiMn2O4发生还原反应,a错误。充电时,阴极反应式为:Li++e-=Li,D错误,阳极反应式为:Li2Mn2O4-e-= L i++LiMn2O4,故应是Li2Mn2O4发生氧化反应,而不是LiMn2O4,C错误。本题应选B。
点评:本题主要考查电化学知识和氧化还原反应的有关知识,虽然新型电池增加了试题的陌生度,但考查原电池及电解池的原理不变,这是解答本类试题的关键。
4.可充电电池离子的移动方向判断及总反应式的书写
例4(2006年江苏化学卷第14题)锂离子电池已成为新一代实用化的蓄电池,该电池具有能量密度大、电压高的特性。锂离子电池放电时的电极反应式为:负极反应:C6Li-xe-=C6Li1-x+xLi+(C6Li表示锂原子嵌入石墨形成的复合材料);正极反应:Li1-xMO2+xLi++xe-=LiMO2(LiMO2表示含锂的过渡金属氧化物)下列有关说法正确的是( )
A. 锂离子电池充电时电池反应为C6Li+Li1-xMO2=LiMO2+C6Li1-x
B. 电池反应中锂、锌、银、铅各失1mol 电子,金属锂所消耗的质量最小
C. 锂离子电池放电时电池内部Li+向负极移动
D. 锂离子电池充电时阴极反应为C6Li1-x+xLi++xe—=C6Li
解析:将放电的两电极反应式在电子守恒的基础上相加即得放电时的总反应式:C6Li+Li1-xMO2=LiMO2+C6Li1-x,充电时的总反应式应为放电总反应式的逆反应,故A错误;在锂、锌、银、铅金属中,锂的摩尔质量最小,所以各失去1mol 电子,消耗金属锂的质量最小,B正确。电池工作时,阴离子向负极移动,阳离子向正极移动,C错误。充电时的阴极反应与放电时的负极反应互为逆反应,故D正确。本题应选BD。
点评:本题以锂离子电池为背景材料,全面考查了蓄电池的反应原理、电极反应、离子流向等知识,要求考生能将所学知识灵活迁移运用。
5.可充电电池考点的综合应用
例5(2006年重庆理综卷第27题)铅蓄电池是典型的可充型电池,它的正负极格板是惰性材料,电池总反应式为:
Pb+PbO2+4H++2SO42- 2PbSO4+2H2O
2PbSO4+2H2O
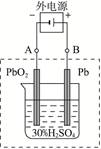
请回答下列问题(不考虑氢、氧的氧化还原):
⑴放电时:正极的电极反应式是 ;电解液中H2SO4的浓度将变 ;当外电路通过1mol 电子时,理论上负极板的质量增加 g。
⑵在完全放电耗尽PbO2和Pb时,若按右图连接,电解一段时间后,则在A电极上生成 、B电极上生成 ,此时铅蓄电池的正负极的极性将 。
解析:⑴根据总反应式中化合价的升降,可判断出两极,从而写出它的两电极反应:负极:Pb+SO42--2e-=PbSO4,正极:PbO2+4H++SO42-+2e-=PbSO4+2H2O。根据总反应式H2SO4的浓度会不断减小,所以应定期补充H2SO4。根据负极反应:Pb+SO42--2e-=PbSO4,可知,每转移2 mol 电子,负极板增加1mol 的质量,因为负极板由Pb变为PbSO4,故外电路通过1mol 电子时,理论上负极板的质量增加48g。
⑵当外加电源后,铅蓄电池变成了电解池,A极为阴极,电极反应式为:PbSO4+2e-=Pb+SO42-,B极为阳极,电极反应式为:PbSO4+2H2O-2e-=PbO2+4H++SO42-。这样,A电极上生成Pb,B电极上生成PbO2,此时铅蓄电池的正负极的极性将对换。
答案:⑴PbO2+2e-+4H++SO42-=PbSO4+2H2O 小 48 ⑵ Pb PbO2 对换
点评:本题关于电化学,正确书写电极反应式是解决本类问题的关键。在书写过程中要注意,电极产物是否与电解质溶液共存,不共存要参与电极反应,如本题中的与Pb2+与SO42-不共存,要发生反应生成PbSO4。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。电化学原理是普通高中化学选择性必修1化学反应原理中的重要组成部分,也是高考化学中...
一、判断有机物得失电子 例1: 微生物电池是指在微生物的作用下将化学能转化为电能的...
近几年全国卷高考电化学装置一般都带有离子交换膜,此类题目新颖度高,学生因理不清交...
【 知识归纳 】 1. 浓差电池的定义 物质由 高浓度 向 低浓度 扩散而引发的一类电池称...
锌溴液流电池是一种大规模储能电池,相比传统铅酸电池锂离子电池等,把电解质存放在容...
11111...