
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
1.原理认识
例1:关于如图所示装置的叙述中,正确的是
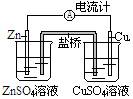
A.铜是阳极,铜片上有气泡产生
B.铜片质量逐渐减少
C.铜离子在铜片表面被还原
D.电流从锌片经导线流向铜片
解析:这是原电池装置,其反应原理是Zn+CuSO4= ZnsO4+Cu。左池中Zn棒失去电子(通过导线流向Cu棒,是负极)成为Zn2+进入溶液中,使ZnsO4溶液中Zn2+过多,带正电荷。右池中由导线流过来的Cu棒(正极)上富集电子,Cu2+获得电子沉积为Cu,溶液中Cu2+过少,SO42-过多,溶液带负电荷。由于盐桥的存在,其中Cl-向ZnsO4溶液迁移,K+向CuSO4溶液迁移,分别中和过剩的电荷,使溶液保持电中性,反应可以继续进行。
答案:C。
点拨:与同单池的原电池一样,活泼金属做负极,不活泼的金属做负极;为使溶液保持电中性,盐桥中离子的定向迁移构成了电流通路,盐桥既可沟通两方溶液,又能阻止反应物的直接接触。
2.设计感知
例2:控制适合的条件,将反应2Fe3++2I-![]() 2Fe2++I2设计成如图所示的原电池。下列判断不正确的是
2Fe2++I2设计成如图所示的原电池。下列判断不正确的是
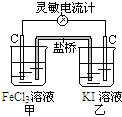
A. 反应开始时,乙中石墨电极上发生氧化反应
![]() B. 反应开始时,甲中石墨电极上Fe3+被还原
B. 反应开始时,甲中石墨电极上Fe3+被还原
![]() C. 电流计读数为零时,反应达到化学平衡状态
C. 电流计读数为零时,反应达到化学平衡状态
![]() D. 电流计读数为零后,在甲中溶入FeCl2固定,乙中石墨电极为负极
D. 电流计读数为零后,在甲中溶入FeCl2固定,乙中石墨电极为负极
解析:乙中I-失去电子放电,故为氧化反应,a项正确;由总反应方程式知,Fe3+被还原成Fe2+,b项正确;当电流计为零时,即说明没有电子发生转移,可证明反应达平衡,C项正确。加入Fe2+,导致平衡逆向移动,则Fe2+失去电子生成Fe3+,而作为负极,D项错。
答案:D。
点拨:有盐桥的原电池的两个电极的材料可以不同,也可以相同,但环境绝对不同。一定要从总反应的原理出发,分析原电池的正负极。
3.知识迁移
例3:已知反应AsO43-+2I-+2H+![]() AsO33-+I2+H2O,现设计如下实验装置,进行下述操作:
AsO33-+I2+H2O,现设计如下实验装置,进行下述操作:
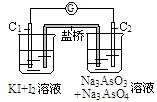
(I)向b杯内逐滴加入浓盐酸,发现微安表指针偏转;
(II)若改向b烧杯中滴加40%NaOH溶液,发现微安表指针与(I)实验的反向偏转。试回答下列问题:
(1)两次操作中指针为什么发生偏转?
(2)两次操作过程中指针偏转方向为什么相反?试用化学平衡移动原理解释之。
(3)(I)操作过程中C1棒上发生的反应为 ;
(4)(II)操作过程中C2棒发生的反应为 。
解析:由于反应AsO43-+2I-+2H+![]() AsO33-+I2+H2O是可逆的,也是氧化还原反应。而且满足:①不同环境中的两电极(连接);②电解质溶液(电极插入其中并与电极自发反应);③形成闭合回路。构成原电池的三大要素。
AsO33-+I2+H2O是可逆的,也是氧化还原反应。而且满足:①不同环境中的两电极(连接);②电解质溶液(电极插入其中并与电极自发反应);③形成闭合回路。构成原电池的三大要素。
当加酸时c(H+)增大,平衡向正向移动;C1:2I--2e-=I2,这是负极;C2:AsO43-+2H+ +2e-=AsO33-+H2O,这是正极。
当加碱时c(OH-)增大,平衡向逆反应方向移动:C1:I2+2e-=2I-,这是正极;C2:AsO33-+ 2OH--2e-=AsO43-+H2O,这是负极。
答案:(1)两次操作中均能形成原电池,化学能转变成电能。
(2)(I)加酸c(H+)增大,平衡向正向移动,AsO43-得电子,I-失电子,所以C1极是负极,C2极是正极。(II)加碱c(OH-)增大,平衡向逆反应方向移AsO33-失电子,I2得电子,此时,C1极是正极,C2极是负极。故化学平衡向不同方向移动,发生不同方向的反应,电子转移方向不同,即微安表指针偏转方向不同。
(3) 2I-2e-=I2
(4)AsO33-+2OH--2e-=AsO43-+H2O
点拨:G中指针往相反方向旋转,暗示电路中电子流向相反,说明总反应的平衡移动方向相反。
练习:
1.下面甲、乙两装置都是铜-锌原电池。
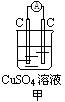
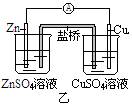
(1)甲、乙两装置中,正负极上的电极反应 ,反应现象 。
A.相同 B.不同
(2)其中, 装置能更彻底的将反应所释放的能量转化为电能。
2.某原电池构造如右图所示。下列有关叙述正确的是
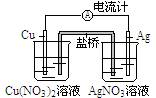
A.在外电路中,电子由银电极流向铜电极
B.取出盐桥后,电流计的指针仍发生偏转
C.外电路中每通过0.1 mol 电子,铜的质量理论上减小6.4 g
D.原电池的总反应式为Cu+2AgNO3=2Ag+Cu(NO3)2
3. 如图所示,杠杆Ab两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向水槽中滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑两球的浮力变化)
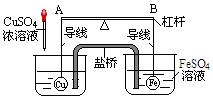
A.杠杆为导体或绝缘体时,均为a端高b端低
B.杠杆为导体或绝缘体时,均为a端低b端高
C.当杠杆为导体时,a端低b端高;杠杆为绝缘体时,a端高b端低
D.当杠杆为导体时,a端高b端低;杠杆为绝缘体时,a端低b端高
答案:1. (1)A A (2)乙。2.D。3.C。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。电化学原理是普通高中化学选择性必修1化学反应原理中的重要组成部分,也是高考化学中...
一、判断有机物得失电子 例1: 微生物电池是指在微生物的作用下将化学能转化为电能的...
近几年全国卷高考电化学装置一般都带有离子交换膜,此类题目新颖度高,学生因理不清交...
【 知识归纳 】 1. 浓差电池的定义 物质由 高浓度 向 低浓度 扩散而引发的一类电池称...
锌溴液流电池是一种大规模储能电池,相比传统铅酸电池锂离子电池等,把电解质存放在容...
11111...