
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
中学阶段,学生是在学习二氧化硫的漂白性时才开始接触品红试剂的。二氧化硫与品红结合成一种不稳定的无色物质,该物质受热又会分解, 这也是二氧化硫的经典检验方法。当讲到该知识 点时,多数教师通常会比较氯气使品红溶液褪色 与二氧化硫使品红溶液褪色的区别。前者是氧化漂白,漂白后的溶液受热后不复原,而后者是化合漂白,漂白后的溶液受热后又会恢复原来的颜色。 也有部分教师会提及活性碳,它使品红溶液褪色属于吸附漂白。至于这三类试剂是如何使品红溶 液褪色的,其褪色原理怎样则不一定很清楚。除 了以上三类试剂能使品红溶液褪色外,中学阶段, 还有没有其他也能使品红溶液褪色的试剂呢?其 实除二氧化硫、强氧化剂、活性碳能使品红溶液褪 色外,还有四类试剂也能使品红溶液褪色。笔者 就品红溶液在七类试剂中的褪色原理进行简要的分析,供参考。
一、二氧化硫使品红溶液褪色原理浅析
品红作为一种有机化学试剂,由于显色灵敏, 反应快,操作方便,常被用作物质的检验,尤其是二氧化硫的检验。它的结构为
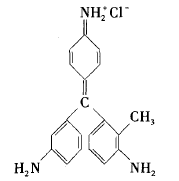
其发色基团是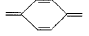 ,只要破坏该基团,品红溶液就会褪成无色。品红试剂不但含有发色基 团,还含有助色基团。它的助色基团为一NH2 ,如果被破坏,溶液的颜色会变淡或褪成其他的淡颜 色。二氧化琉与品红发生反应的化学方程式和产 物受热分解反应的化学方程式如下:
,只要破坏该基团,品红溶液就会褪成无色。品红试剂不但含有发色基 团,还含有助色基团。它的助色基团为一NH2 ,如果被破坏,溶液的颜色会变淡或褪成其他的淡颜 色。二氧化琉与品红发生反应的化学方程式和产 物受热分解反应的化学方程式如下:
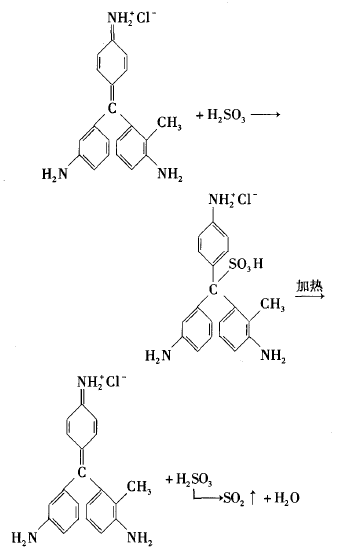
二氧化硫与品红溶液的反应从有机反应类型分类看,属于亚硫酸与品红中的C = C共轭双键的加成反应;若从无机反应类型分类看,属于亚硫酸 与品红的化合反应,也即通常说的化合漂白。二 氧化硫破坏的是品红试剂的发色基团,因而溶液褪成无色。但是该无色物质的稳定性较差,加热又会分解。值得一提的是此两个反应并不是可逆 反应,也就是说不能用平衡移动原理来分析这两个反应的转化关系。事实证明往褪色后的品红溶液中试图通过削减二氧化硫的浓度如加碱中和亚硫酸或加强氧化剂氧化亚硫酸,都不会出现预期的红色现象。
二、亚硫酸盐或亚硫酸氢盐使品红溶液褪色原理浅析
亚硫酸盐和亚硫酸氢盐在水溶液中都会发生 水解反应产生亚硫酸。以Na2SO3、NaHSO3为例。 Na2SO3水解的离子方程式为:
SO32- +H2O  HSO3-+ OH-
HSO3-+ OH-
HSO3-+H2O H2SO3 + OH-
H2SO3 + OH-
NaHSO3的水解离子方程式为:HSO3- +H2O  H2SO3 + OH-
H2SO3 + OH-
所以亚硫酸盐和亚硫酸氢盐使品红试剂褪色的原理与二氧化硫使品红试剂褪色原理是相同的,都是通过加成反应来破坏品红结构中的发色基团实 现的。以Na2SO3与品红反应的离子方程式为例, 其反应可表示为:
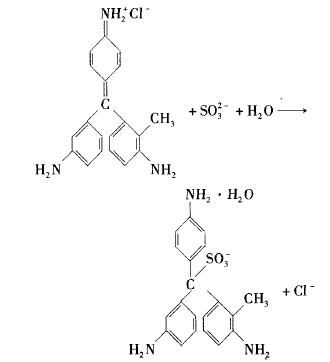
由于亚硫酸盐和亚硫酸氢盐性质相对亚硫酸更稳定,且与品红反应后生成的加合物对热更稳 定。因此工业上常用亚硫酸钠作漂白剂,而不是直接用二氧化硫或亚硫酸进行漂白。
三、酸使品红溶液褪色原理浅析
从品红结构看,它的两个助色基团氨基具有碱性,可以和酸反应。所以品红也可以和酸反应 生成盐。由于品红结构中的助色基团在酸性溶液中会遭到破坏,因此酸也能使品红溶液褪色,只不过不是褪成无色,而是褪成浅黄绿色。如H2SO4与品红反应的化学方程式为:
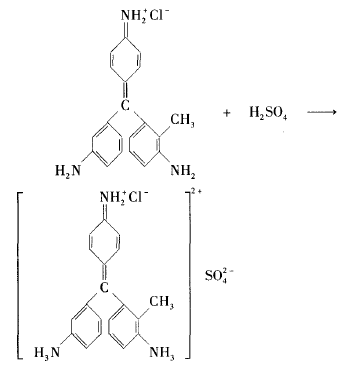
四、碱使品红溶液褪色原理浅析
品红结构中的R = NH2 (R代表剩余部分)遇碱时能与OH-结合成分子:R= NH • H2O,破坏品红结构中的发色基团,导致品红溶液褪色。 以NaOH与品红溶液反应为例,其化学方程式如 下:
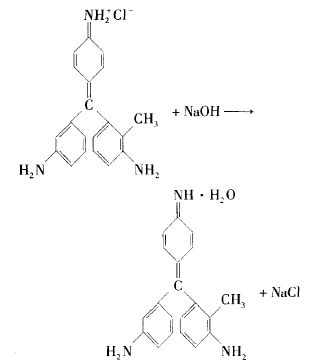
当往品红溶液中加人少许2 mol/L NaOH溶 液时,可以看到品红红色褪去,有红色粉末状沉淀 生成。
五、氧化剂使品红溶液褪色原理浅析
品红分子中含有双键(-C = C -)以及 -NH2,它们都具有一定还原性。能被氧化剂氧化,破坏品红结构中的发色基团和助色基团,从而导致品红褪色。常见的氧化剂有氯气、次氯酸、过氧化氢等。
六、还原剂使品红溶液褪色原理浅析
品红分子中含有双键(-C = C-),能被还原剂还原。因此还原剂也能使品红褪色。SnCl2和 Na2S等具有较强的还原性,能将品红还原成无色 物质。该物质对热不稳定,加热后又向生成品红方向进行反应。h2o2中的氧元素为-1价,既可表现为氧化性,也可表现为还原性。在中性溶剂中 H2O2氧化性、还原性均较弱,不足以将品红氧化 或还原,即不能使品红褪色。众所周知,在酸性溶 剂中,H2O2具有极强的氧化能力,它可将-NH2 氧化而使品红褪色,体现的是氧化漂白。在碱性溶液中H2O2以还原性为主。能将品红还原而使之褪色,体现的是还原漂白。
七、活性碳使品红溶液褪色原理浅析
由于活性碳结构含有很多小孔能吸附有机色素,品红是一种有机色素,被活性炭吸附后其溶液为无色。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。硝化作用:氨氮到硝酸盐的神奇变身 硝化作用是土壤微生物参与的将氨氮(NH 3 /NH 4 + ...
磷有多种含氧酸,较重要的有以下几种: 名 称 正磷酸 焦磷酸 亚磷酸 次磷酸 三磷酸 偏...
硒相关知识在信息题量经常会涉及,为此,能对硒有一些了解也会大有益处的。 1、保健元...
石膏的利用与开发 人类对石膏的利用,至少也有上千年了。古代的中医就用石膏作为清热...
铵盐都是离子化合物。 离子化合物溶于水经历两个基本过程,一是吸收能量离子键的断裂...
氮气与氩气都是惰性气体!只是氮气没氩气惰,看看他们的性质吧: 一、氮气: 1.物理性...