
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
我国现行高级中学化学教科书中的酸、碱和盐溶解性表,将碳酸铁(ⅲ)不溶于水改成在水中不存在。这是由于Fe(H2O)63+中Fe 3+的电荷多,半径小,电荷的平方与半径之比值大(Z2/r=3515c2·m-1×1028),所以它的极化能力强。在Fe(H2O)63+中,Fe 3+ 对配位的极性H2O分子中带负电荷的氧原子的吸引力和对带正电荷的氢原子的推斥力均较大,使水分子离解质子的能力增强。因此Fe(H2O)63+能给出质子,是质子酸。Fe(OH)3的溶度积小(ksp=1.1×10-36),也能促使Fe(H2O)63+的水解性增大,而使它的溶液呈现较强的酸性。在易溶性铁(ⅲ)盐溶液中,加入碱金属的碳酸盐溶液时,便生成胶状Fe(OH)3沉淀,放出气体CO2,其反应可用离子方程式(1)表示。通过298k,反应物和产物的标准生成自由能(δfG298°),可求得反应(1)的标准自由能变(δfG298°)和标准平衡常数(k°)。
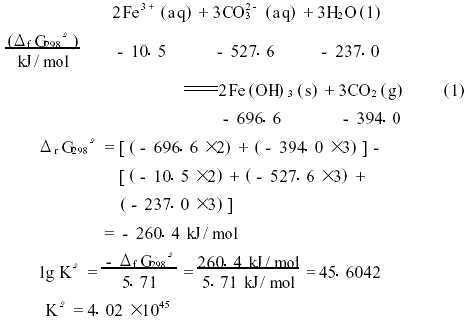
显而易见,反应(1)是不可逆的,能够进行到底。
如果在Fe 3+溶液中,加入碳酸钠溶液,使二者的浓度均为0.100mol/l,就能由CO3 2-的一级水解反应,求出[OH-]=4.22×10-3。
生成Fe(OH)3的离子积(K)为K=[Fe 3+ ][OH- ]3=0.100×(4.22×10-3)3=7.51×10-9。
K>>ksp,因此,在这个溶液中能生成胶状Fe(OH)3沉淀。
由以上2个计算都能说明在水溶液中不存在碳酸铁(ⅲ)。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
水溶液中NH水解显酸性,CO、HCO水解显碱性,二者会发生“相互促...
在基础化学中,我们常被告知:盐类水解通常是微弱且可逆的。...
一般来说,溶解度大的物质易转化为溶解度小的物质。那反过来...
一.定义 1.pH pH=–log[H] pH是衡量溶液整体酸碱度的指标,具体指溶...
溶解度(Solubility)与溶度积常数(Solubility Product Constant, ksp密切...
【导读】与第一电离能定义相反(并非严格互逆过程),第一电子...