
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、相对式量法
根据相对式量确定元素化合价时,首先要会写物质的化学式。当某元素R的化合价为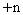 ,则其卤化物、硝酸盐、醋酸盐、氢氧化物等一价阴离子的化合物通式为
,则其卤化物、硝酸盐、醋酸盐、氢氧化物等一价阴离子的化合物通式为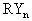 (
(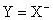 ,
,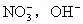 等),而其氧化物、硫酸盐、碳酸盐等二价阴离子的化合物的化学式则有2种情况:
等),而其氧化物、硫酸盐、碳酸盐等二价阴离子的化合物的化学式则有2种情况:
当n为奇数时,化学式为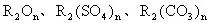 ;
;
当n为偶数时,化学式为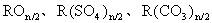 。
。
例1、某金属元素最高价氧化物的水化物的相对分子质量为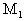 ,其最高价氧化物的相对分子质量为
,其最高价氧化物的相对分子质量为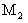 ,若此元素的最高正价为n,则
,若此元素的最高正价为n,则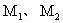 关系可能是( )
关系可能是( )
A. 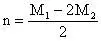
B. 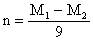
C. 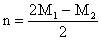
D. 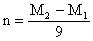
解析:从题给的信息可知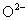 为二价阴离子,存在化学式有2种情况,当n为奇数时,化学式为
为二价阴离子,存在化学式有2种情况,当n为奇数时,化学式为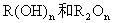 。
。
则
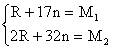
当n为偶数时,化学式为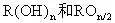
则
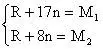
正确答案A、B。
二、分类讨论法
某些试题中,已知条件少,开放性大,答案多个,这就要求学生能够根据题给条件,分类别进行讨论,从而得出正确的结论。
例2、某单质能与浓硫酸反应,若参加反应的单质与硫酸的物质的量比为1:2,则该元素在反应中所显示的化合价可能是( )
A. +1
B. +2
C. +3
D. +4
解析:单质分为金属和非金属两类,因而分2种情况讨论,设金属M为x价,非金属R为y价,得:
x、y为偶数时:
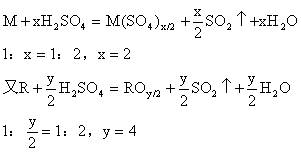
x、y为奇数时:

答案B、D。
三、结构判断法
在共价化合物里,某元素一个原子形成了几个极性共用电子时,该元素的化合价就是几,电子对偏向该元素则显负价,偏离该元素则显正价。
例3、三聚氰酸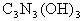 可用于消除汽车尾气中氮氧化物(如
可用于消除汽车尾气中氮氧化物(如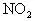 )。当加热至一定温度时它发生如下分解:
)。当加热至一定温度时它发生如下分解: 。HNCO(异氰酸,其结构是H-N=C=O)能和
。HNCO(异氰酸,其结构是H-N=C=O)能和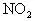 反应生成
反应生成 。试写出HNCO和NO反应的化学方程式,指明HNCO中各元素的化合价,标出电子转移的方向和数目。
。试写出HNCO和NO反应的化学方程式,指明HNCO中各元素的化合价,标出电子转移的方向和数目。
解析:考生虽然不认识三聚氰酸、异氰酸,但是只要从H-N=C=O结构中,准确判断出N的化合价,问题就迎刃而解了。从元素周期律可知非金属性O>N>C,又从异氰酸结构可知C有4个共价键,肯定为+4价,O有2个共价键为-2价,H为+1价,那么N一定为-3价,即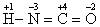 ,它与NO发生的反应是典型的归中反应:
,它与NO发生的反应是典型的归中反应:
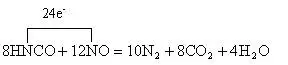
四、价态组合法
化合价有正负之分,变价之意。对于一些含变价元素的复杂物质,确定其化合价时应先把元素可能呈现的几种价态逐一组合,然后根据化合价规则求解。
例4、录象用高性能磁粉的主要材料之一是由3种元素组成的化学式为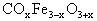 的化合物,已知氧为-2价,钴(Co)和铁可能呈现+2价和+3价。该化合物中每种元素只有一种化合价,x值为_________,铁的化合价为_________,钴的化合价为_________。
的化合物,已知氧为-2价,钴(Co)和铁可能呈现+2价和+3价。该化合物中每种元素只有一种化合价,x值为_________,铁的化合价为_________,钴的化合价为_________。
解析:在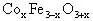 中氧为-2价,钴、铁有变价。因各元素只有一种价态,故将价态分别组合后可求得x=1,Co为+2价,Fe为+3价。
中氧为-2价,钴、铁有变价。因各元素只有一种价态,故将价态分别组合后可求得x=1,Co为+2价,Fe为+3价。
五、转换角度法
转换思维切入的角度,会使思维进入豁然开朗的境界。
例5、X、Y、Z、W、Q均为含氮的化合物,我们不了解它们的化学式,但知道它们一定条件下有如下的转换关系(未配平)。
(1)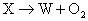
(2)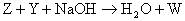
(3)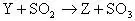
(4)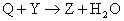
(5)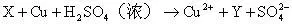
这5种化合物中氮元素的化合价由高到低的顺序为( )
A. Q>W>Z>X>Y
B. X>Y>W>Z>Q
C. W>Y>Z>Q>X
D. Z>X>W>Y>Q
解析:如果期望先推出W、Q、X、Y、Z各为何种含氮化合物,再排定氮元素化合价高低,其结果只能是无功而返。此时,最好的方式是转换思维角度,运用氧化还原反应的规律(升降规律、歧化规律、归中规律)分析题目转化关系:由(1)得出X高于W,氧升高则X、W氮化合价必降低。分析(3),硫化合价升高,则Y到Z氮化合价必降低。再分析(2)和(4),W介于Z和Y之间;Z介于Q和Y之间。最后分析(5),铜化合价升高,则X到Y氮化合价必降低,有X>Y。所以结论为X>Y>W>Z>Q。答案为B。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。说明: 1.不同于大学所说的“氧化数”,高中所学的“化合价”只是一个工具,是为了更...
氧化还原反应的很多规律,如化合价有升必有降、电子有得必有失,而且升降总数相等、得...
配平氧化还原反应方程式的基本方法相同,关键是针对具体的反应往往有不同的配平技巧。...
氧化性、还原性的强弱主要取决于物质本身得失电子的难易程度而不取决于得失电子数目的...
得失电子守恒是氧化还原反应的核心,根据这一原理,既可配平氧化还原方程式,又可进行...
1 问题的提出 “氧化还原反应”在中学化学知识中占据着关键性位置,是电化学的基础,...