
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
高一新教材关于铜与浓硫酸反应的实验描述是这样的:“实验表明,浓硫酸与铜在加热时能发生反应,放出能使紫色石蕊试液变红或使品红溶液褪色的气体,反应后生成物的水溶液显蓝色。说明铜与浓硫酸反应时被氧化为二价铜离子”。
然而该实验的现象这么简单,且实验有两种情况:
一种情况是浓硫酸过量。用下列“实验装置图1”(固定仪器和加热酒精灯均未画出)来完成此实验。其实验现象有(按实验进程):铜与冷的浓硫酸不发生反应,加热时随浓硫酸温度升高铜丝(或铜片)表面变黑,产生气泡,细小黑色颗粒状物质从铜丝(或铜片)表面进入浓硫酸中,形成黑色的悬浊液。随着加热温度继续升高(至沸腾),黑色颗粒状物质与浓硫酸反应,转变成细小灰白色的颗粒状物质,随浓硫酸一起翻滚。在此过程中试管里还产生了大量的白色烟雾,起初部分烟雾在试管上部内壁冷凝析出淡黄色固体物质。在持续加热浓硫酸(沸腾)时,淡黄色固体物质有慢慢消失了。此间导气管出的气体分别使紫色石蕊试液变红,使品红溶液和KMnO4溶液褪色。当铜全部反应后,停止加热静置时,试管内的烟雾也随之慢慢消失了,试管中的液体呈浅蓝色,管底沉积的固体物质呈灰白色。继续冷却试管时,溶液颜色慢慢变浅,至室温时几乎无色。将此无色溶液注入盛有少量水的试管中,所得溶液变为浅蓝色。再向残留有灰白色固体的试管中滴加少量蒸馏水时,所得溶液呈蓝色,试管底部未溶固体的上层部分呈蓝色,下层仍为灰白色(久置时可变为蓝色)。
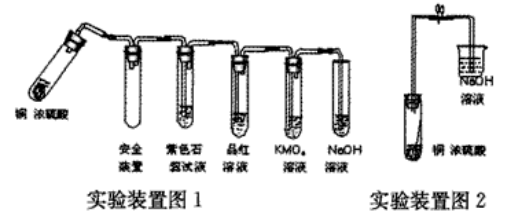
另一种情况是铜过量。用“实验装置图2”(固定仪器和加热酒精灯均未画出)完成此实验。为了便于观察有关反应现象和验证产物,将细铜丝一端卷成螺旋状没入浓硫酸中,另一端露置在液面上方(如图2所示)。长玻璃导管是让挥发的浓硫酸和水冷凝回流。开始加热反应时的现象与前者相同。随着反应的不断进行,试管和长导气管内壁有少量淡黄色固体物质凝聚。露置于试管液面上方的光亮铜丝逐渐变黑。一会儿后试管里的硫酸全部反应完,试管里的物质变为灰黑色的固体。取出试管中原来露置液面上变黑的铜丝,将其分别置于盛有一定量的浓硫酸和稀硫酸的两支试管中,震荡,铜丝表面的黑色物质不溶。若将光亮的铜丝在空气中加热变黑后,再分别置于盛有浓硫酸和稀硫酸的两支试管中时,震荡,发现置于稀硫酸中的铜表面的黑色物质全部溶解,光亮的铜露出;浓硫酸中的铜表面的黑色物质只有部分溶解。
从上述实验现象来看,教材中的描述的实验现象是过于简单,容易引起学生形成一些模糊认识。是此教者在教学中可做对比实验,并示其学生掌握知识的情况作适当的分析交代,一是澄清学生中产生的模糊认识,使之准确理解;二是供一部分学有余力的学生和兴趣爱好者在课外进行研究性学习。
有关实验现象分析如下:
1.硫酸于铜共热时溶液中先产生黑色物质后变成灰白色物质的原因
浓硫酸与铜共热反应是分步进行的,铜先被浓硫酸氧化为黑色的氧化铜,氧化铜再与硫酸反应生成硫酸铜,这是反应过程中的主要化学反应,其反应的方程式为:
Cu+H2SO4(浓) CuO+SO2↑+H2O
CuO+SO2↑+H2O
CuO+H2SO4(浓) CuSO4+H2O
CuSO4+H2O
该过程的净化反应可表示为:
Cu+H2SO4(浓) CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
同时反应过程中还伴有一些副反应,如生成有CuS、Cu2S等黑色物质,随着反应的进行,这些物质又被浓硫酸氧化生成硫酸铜、二氧化硫、硫等物质。其副反应有:
5Cu+4H2SO4(浓) 3CuSO4+Cu2S+4H2O
3CuSO4+Cu2S+4H2O
Cu2S+2H2SO4(浓) CuSO4+CuS+SO2↑+2H2O
CuSO4+CuS+SO2↑+2H2O
CuS+2H2SO4(浓) CuSO4+SO2↑+S+2H2O
CuSO4+SO2↑+S+2H2O
S+2H2SO4(浓) 3SO2↑+2H2O
3SO2↑+2H2O
反应过程中产生的黑色物质是CuO、Cu2S、CuS等,后来转变为灰白色物质是未溶解于浓硫酸中的CuSO4。
2.产生大量白色烟雾及凝聚的淡黄色固体物质慢慢消失的原因
由于反应溶液处于沸腾状态(浓硫酸的沸点温度为338℃),反应中生成的水及一定量的硫酸蒸气,因而在试管上方形成了硫酸的酸雾。浓硫酸与铜共热时的副反应中生成的硫在此温度下有一部分变成了硫蒸气从溶液中逸出,硫蒸气先被冷凝成淡黄色固体附着在试管内壁上。随着试管内温度的逐渐升高,硫酸蒸气将凝聚的硫氧化为二氧化硫而慢慢消失。其反应的方程式为:
S+2H2SO4(浓) 3SO2↑+2H2O
3SO2↑+2H2O
3.“实验装置图2”试管中露置铜丝变黑的原因
“实验装置图2”试管中露置铜丝变黑,既不是被试管中空气里的氧气氧化为氧化铜,也不是被挥发的硫酸蒸气氧化为氧化铜。因实验证明氧化铜能溶于浓硫酸或稀硫酸中(酸雾冷凝的硫酸溶液比浓硫酸的浓度小,氧化铜能溶解其中)。是此,该黑色物质是产生的硫蒸气与铜反应生成的硫化亚铜。其反应方程式为:
S(蒸气)+2Cu Cu2S
Cu2S
实验证明该黑色物质既不溶于冷的浓硫酸又不溶于稀硫酸,这正是硫化亚铜的性质(硫化亚铜只能被处在高温状态的浓硫酸氧化)。
【例1】
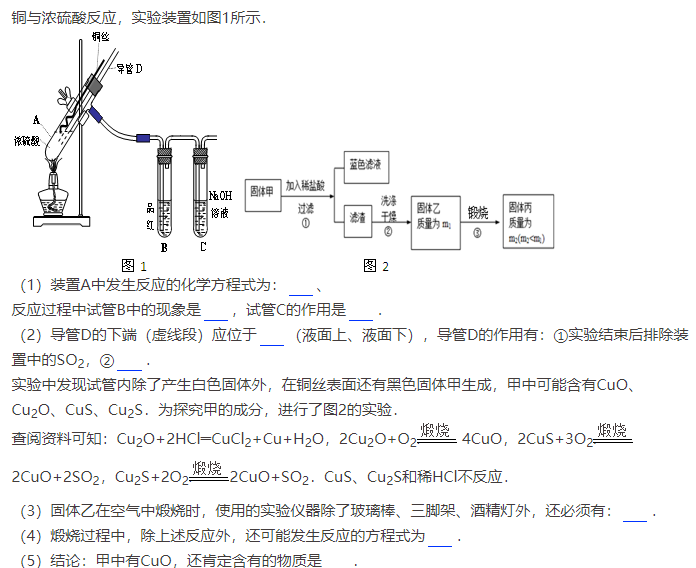

【例2】


【例3】(21届高考化学二轮复习专练)某同学按下图实验装置探究铜与浓硫酸的反应,记录实验现象如表,下列说法正确的是( )
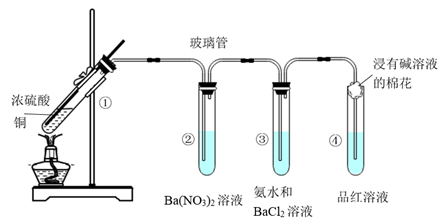
A.②③中白色沉淀都是BaSO4
B.实验开始时①中的黑色固体可能是CuO
C.为了确定①中白色固体是否为硫酸铜,可向冷却后的试管中注入水,振荡
D.加热④中褪色后的溶液,溶液不变色
【答案】B
【解析】
A.②中含有硝酸根,在酸性条件下会把二氧化硫氧化成硫酸,生成的白色沉淀BaSO4
,③中二氧化硫和氨水反应生成生成亚硫酸根,和钡离子结合生成白色沉淀是BaSO3,a错误;
B.一开始硫酸浓度较大,直接把铜氧化成氧化铜,而后硫酸变稀,黑色固体溶解,b正确;
C.反应后剩余硫酸浓度仍然较大,稀释时应该将剩余溶液加入水中稀释以免液体飞溅,C错误;
D.二氧化硫使品红溶液褪色,是二氧化硫与有色物质结合生成不稳定的无色物质,加热可以恢复,所以加热品红溶液恢复红色,D错误;
故选B。
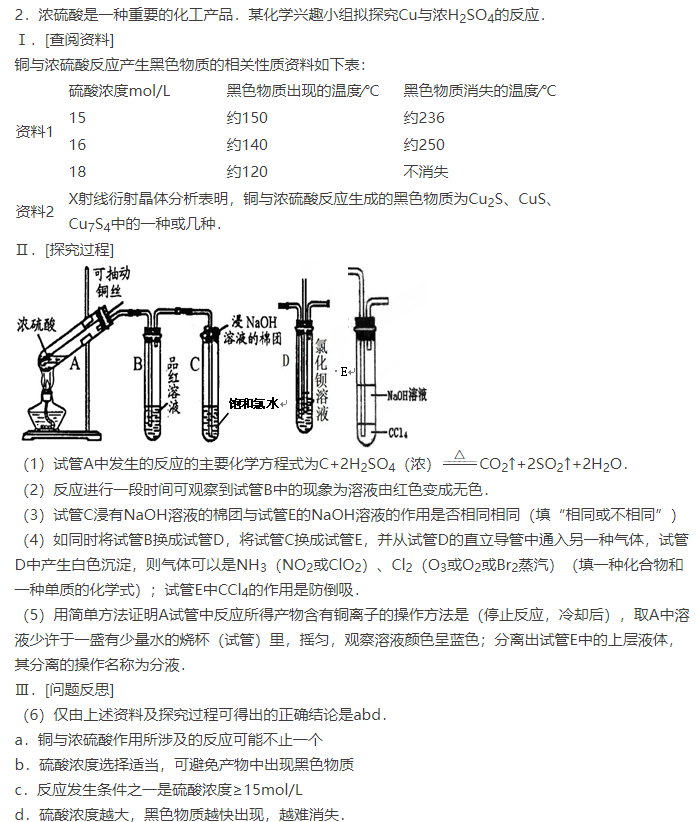
【例4】


 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。在化学课本里有这样一段话:在稀释浓硫酸时,只能把浓硫酸慢慢地倒入水中,而决不能把...
浓硫酸稀释放热原因 1.浓硫酸溶于水时,硫酸分子克服分子间的引力,分散到溶剂 (水)分...
浓硫酸稀释操作不当会引发喷溅、爆炸?今天用最直观的方式教你安全稀释浓硫酸,并解释...
在很多教辅书中,硫沉淀一般被描述成淡黄色沉淀,而在人教版《化学必修二》“实验活动...
一、铁离子的催化作用 审题点1:对比催化效果时,注意浓度是否一致 【示例1】请判断:...
一:硫单质颗粒大小的影响 颗粒极小时呈乳白色: 当反应生成 硫单质 的初始阶段, 硫...