
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、亚硫酸钠变质的原因
亚硫酸钠比二氧化疏有更强的还原性,易被 空气中的氧气所氧化:
2Na2SO3+O2= 2Na2SO4
通常所说的亚硫酸钠变质即指被氧化生成硫 酸钠.
二、亚硫酸钠变质程度的定性检验
要检验某亚硫酸钠粉未是否变质,是部分变质还是完全变质,可用同样两种试剂检验:BaCl2 溶液和稀盐酸。根据两试剂滴加顺序不同,可分为以下3种方法:(取少量样品溶于水)
1.先滴加过量BaCl2溶液,再滴加过量稀盐酸;
2. 滴入用盐酸酸化的BaCl2溶液;
3.先滴入过量盐酸,再滴加BaCl2溶液.。
各种方法对应现象有所不同,应根据情况加以判断。如方法1,滴人过量BaCl2溶液,产生 白色沉淀,再加入过量稀盐酸可有3种情况:
①若沉淀全部溶解并有气泡产生,则说明该亚硫酸钠没有变质;
②若沉淀部分溶解且有气泡产生, 则说明该样品部分变质;
③若沉淀全部不溶解, 无气泡产生,则说明该样品已经全部变质。
这里需要强调的是,不可用硝酸代替盐酸,也 不可以用Ba(NO3)2代替BaCl2(在盐酸过量时加入硝酸钡也会生成硝酸),因为Na2SO3或BaSO3 都会被HNO3氧化,影响判断。
三、亚硫酸钠变质程度的定量测定
欲知亚硫酸钠变质程度如何,或计算Na2SO3的纯度,可进行如下操作:①取W1 g样品溶于水;②加入稍过量的用盐酸酸化的BaCl2溶液; ③过滤,将沉淀用清水洗净;④将沉淀烘干,冷 却,称得其质最为W2 g。
因为W2 g沆淀为BaSO4由此算出W1 g样品中含有Na2SO4为( 142W2/233)g,因此亚硫酸钠的纯度为:
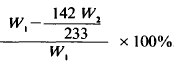
纯度越高,表明变质的纯度越低。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。在化学课本里有这样一段话:在稀释浓硫酸时,只能把浓硫酸慢慢地倒入水中,而决不能把...
浓硫酸稀释放热原因 1.浓硫酸溶于水时,硫酸分子克服分子间的引力,分散到溶剂 (水)分...
浓硫酸稀释操作不当会引发喷溅、爆炸?今天用最直观的方式教你安全稀释浓硫酸,并解释...
在很多教辅书中,硫沉淀一般被描述成淡黄色沉淀,而在人教版《化学必修二》“实验活动...
一、铁离子的催化作用 审题点1:对比催化效果时,注意浓度是否一致 【示例1】请判断:...
一:硫单质颗粒大小的影响 颗粒极小时呈乳白色: 当反应生成 硫单质 的初始阶段, 硫...