
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
氧原子的杂化类型取决于它所处的具体化学环境和成键方式。主要有sp³、sp²、sp和不杂化四种情况。下面分类阐述总结一下:
1. sp³ 杂化 (四面体构型)
这是最常见的情况。
例1: 水 (H₂O)、醇 (R-OH)、醚 (R-O-R') 等分子中与两个原子成键的氧原子均为sp³杂化。
解析:
氧原子的价层电子对总数 = 2 + 2 = 4
理想键角 109.5°,由于2对孤对电子的排斥作用较大,实际键角小于 109.5°
如:水 H₂O 中为 104.5°。
例2:过氧化氢(H-O-O-H)
(1)在过氧化氢(H₂O₂,结构式 H-O-O-H) 中,两个氧原子均采用 sp³ 杂化。
解析:
氧原子的成键环境
每个氧原子形成
1 个 O-O σ 键和1 个 O-H σ 键,携带两对孤对电子。符合四面体电子几何构型(4 个电子域),因此杂化类型为 sp³。
杂化过程与轨道分配
氧原子价电子构型:2s²2p⁴
sp³ 杂化:
1个 2s 轨道 + 3个 2p 轨道 → 4 个 sp³ 杂化轨道
轨道分配:
1 个 sp³ 轨道 → 与另一个氧的 sp³ 轨道形成 O-O σ 键
1 个 sp³ 轨道 → 与氢的 1s 轨道形成 O-H σ 键
剩余 2 个 sp³ 轨道 → 各容纳一对孤对电子
(2)分子几何构型
键角及空间构型:
∠H-O-O ≈ 100°小于理想键角109.5°
二面角(H-O-O-H 扭转角)≈ 111°(气相中,非平面结构), H₂O₂ 呈扭曲的链状结构。如图所示👇🏻
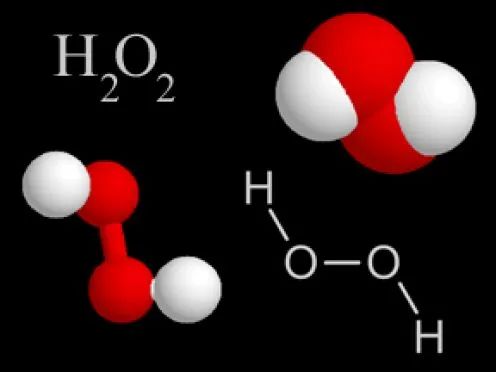
注意不是一个平面,就像一本“翻开一定角度书的两个页面”,似乎在等待着知音读者去探秘一般。
原因:
孤对电子排斥力 > 键合电子排斥力,压缩 H-O-O 键角。
氧原子为 sp³ 四面体中心,但整体分子因孤对电子排斥而折叠。
关键区别:
与水相比,H₂O₂ 因O-O 单键可旋转且存在更多孤对电子排斥,导致其构型更复杂,但氧的杂化本质相同。
番外:氧原子采用sp³还是sp²杂化,是存在争议的,部分资料提及sp²杂化,但主流观点支持sp³。论述如下:
若氧为 sp² 杂化(平面三角形):
键角应接近 120°,但实测 ∠H-O-O ≈ 100°(接近 sp³ 的四面体角)。
而且也无法满足两对孤对电子的空间排布需求。
实验证据:O-O 键长 147 pm(典型单键),O-H 键长 97 pm,均符合 sp³ 杂化预测。
综上所述:
在 H-O-O-H(过氧化氢)中:
每个氧原子均为 sp³ 杂化,价键轨道形成四面体电子几何构型。
分子呈非平面扭曲构型,键角 ∠H-O-O ≈ 100°(孤对电子压缩所致)。
O-O 键为 σ 单键,可自由旋转(能垒仅 ≈ 3 kcal/mol)。过氧键的不稳定性也是因此产生的。
简言之:氧的 sp³ 杂化骨架 + 孤对电子主导的几何扭曲是 H₂O₂ 结构的核心特征。
2. sp² 杂化 (平面三角形构型)
这种情况在羰基化合物中常见。
醛 (R-CHO)、酮 (R-COR')、羧酸 (R-COOH)、酯 (R-COOR')、酰胺 (R-CONR'₂) 等中的羰基氧 (C=O)均为sp² 杂化。
解释:在羰基中,氧与碳形成一个 σ 键和一个 π 键(双键)。
杂化过程:氧原子的一个 2s 轨道和两个 2p 轨道混合,形成三个 sp² 杂化轨道。剩下的一个未参与杂化的 2p 轨道垂直于 sp² 杂化平面。
轨道排布:三个 sp² 杂化轨道呈平面三角形排布(理想键角 120°),此时斥力最小。
电子填充和成键:
一个 sp² 杂化轨道与碳的一个 sp² 杂化轨道重叠形成 C-O σ 键。
另一个 sp² 杂化轨道容纳氧的一对孤对电子。
未参与杂化的 2p 轨道与碳的未参与杂化的 2p 轨道平行重叠形成 C-O π 键。
剩下的一个 sp² 杂化轨道容纳氧的另一对孤对电子。
此外,苯酚中由于p-π共轭,氧的杂化类型为sp²。
3. sp 杂化 (直线形构型)
这种情况相对少见,存在于特殊结构中。
例1:O₂⁻、O₂⁺、O₂²⁺ 中的氧原子
可以认为接近 sp 杂化。
解释:当氧原子需要形成两个相互垂直的 π 键或者处于线性环境中时可能发生。
杂化过程:氧原子的一个 2s 轨道和一个2p 轨道混合,形成两个 sp 杂化轨道。剩下的两个 2p 轨道相互垂直,也垂直于 sp 杂化轨道的轴线。
轨道排布:两个 sp 杂化轨道呈180° 直线排布。
总之,判断氧的杂化类型时,最关键的是看它所形成的 “σ 键的数量”以及 “分子的几何构型”(特别是键角)。
氧的常见杂化情况总结:
sp³ 杂化:
H₂O、醇 (R-OH)、醚 (R-O-R')
sp² 杂化:
醛 (R-CHO)、酮 (R-COR')、羧酸 (R-COOH)、酯 (R-COOR')、酰胺 (R-CONR'₂)
sp杂化:O₂⁻、O₂⁺、O₂²⁺ 、CO

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
冠醚是一类大环多醚化合物,其分子结构呈环状,环上均匀分布...
在高考备考化学试卷里,经常会遇到含钯的催化剂。本文将就钯...
在离子晶体中存在离子极化现象,使得离子键带有一定共价键的...
【情境】:你注意到我们每天都离不开的水有什么反常之处吗?...
氢键的大小(强度)可以通过多种因素来比较,这些因素包括氢键...
...