
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
氧化还原反应的很多规律,如化合价有升必有降、电子有得必有失,而且升降总数相等、得失电子相等,都可以通过氧化还原反应方程式的配平及书写来考查。根据化合价有升必有降可以判断可能的产物,根据电子守恒、原子守恒以及电荷守恒等,可以配平氧化还原反应方程式,因而书写氧化还原反应方程式,尤其是在工艺流程题中对氧化还原反应方程式书写的考查成为一大热点。
一、氧化还原反应方程式配平
1、配平步骤
(1)标变价:标明反应前后变价元素的化合价;
(2)列变化:列出化合价的变化值;
(3)求总数:求最小公倍数,使化合价升降总数相等;
(4)配系数:确定氧化剂、还原剂或氧化产物、还原产物的化学计量数,观察法配平其它物质系数;
(5)查守恒:检查质量、电荷、得失电子是否守恒。

【名师点拨】配平口诀:标变价、列变化、求总数、定系数。
2、配平原则——三守恒
(1)得失电子守恒
特征:氧化还原反应中,化合价有升必有降,升降总数相等。
本质:氧化还原反应中,氧化剂得电子总数等于还原剂失电子总数。
(2)质量守恒
反应前后原子的种类和数目不变。
(3)电荷守恒:对于离子反应方程式,方程式两边阴、阳离子所带电荷总数相等。

二、信息型氧化还原反应方程式的书写
1、书写步骤——四部曲
| 步骤 | 具体内容 |
第1步:列物质 | 氧化剂+还原剂→氧化产物+还原产物 第1步中只写出氧化还原方程式中氧化剂,还原剂,氧化产物,还原产物;除了要求学生掌握教材中的常见物质变化外,陌生方程式总会在题中给出相应信息要求推出产物:如化合价变化、物质变化等 |
第2步:平电子 | 根据电子得失守恒配平所列物质 |
第3步:平电荷 | 根据电荷守恒配平所列物质,当电荷量不相等时,酸性环境补充H+,碱性环境补充OH—,原则是只能补充电解质溶液中含有的离子 |
第4步:平原子 | 根据原子守恒配平反应方程式 |
2、氧化还原反应型离子方程式的书写流程
(1)找出反应微粒:通过氧化还原反应中元素价态的变化,找出发生氧化还原反应的微粒。
(2)正确预测产物:依据氧化还原反应规律确定氧化产物和还原产物。
(3)配平变价微粒:应用最小公倍数法确定得失电子的数目,配平含变价元素的相关物质。
(4)确定缺项物质:根据溶液酸碱性及电荷守恒确定缺项物质是H2O、OH-还是H+。
(5)整体元素配平:通过观察法确定所有物质的化学计量数。
(6)三查检验验证:检查物质拆分是否正确,电荷、质量是否守恒。
【名师点拨】
| 条件 | 补项原则 |
酸性条件下 | 缺H(氢)或多O(氧)补H+,少O(氧)补H2O(水) |
碱性条件下 | 缺H(氢)或多O(氧)补H2O(水),少O(氧)补OH- |
| 反应物 | 生成物 | 使用条件 | |
组合一 | H+ | H2O | 酸性溶液 |
组合二 | H2O | H+ | 酸性溶液或酸碱性未知 |
组合三 | OH- | H2O | 碱性溶液 |
组合四 | H2O | OH- | 碱性溶液或酸碱性未知 |
3、氧化还原反应型方程式的配平模型
先用“化合价升降法”配平含有变价元素的物质的化学计量数,然后由原子守恒确定未知物,再根据原子守恒进行配平。具体为:
(1)全变从左边配:氧化剂、还原剂中某元素化合价全变的,一般从左边反应物着手配平。
(2)自变从右边配:自身氧化还原反应(包括分解、歧化)一般从右边着手配平。
(3)缺项配平法:先使得失电子数配平,再观察两边电荷。若反应物这边缺正电荷,一般加H+,生成物一边加水;若反应物这边缺负电荷,一般加OH-,生成物一边加水。然后进行两边电荷数配平。
【名师点拨】当方程式中有多个缺项时,应根据化合价的变化找准氧化剂、还原剂、氧化产物、还原产物。
典例剖析
典例1. 直接型的配平
H2S+HNO3―→S↓+NO↑+H2O
解析:配平步骤如下:
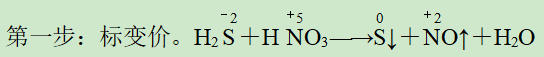
第二步:列得失。
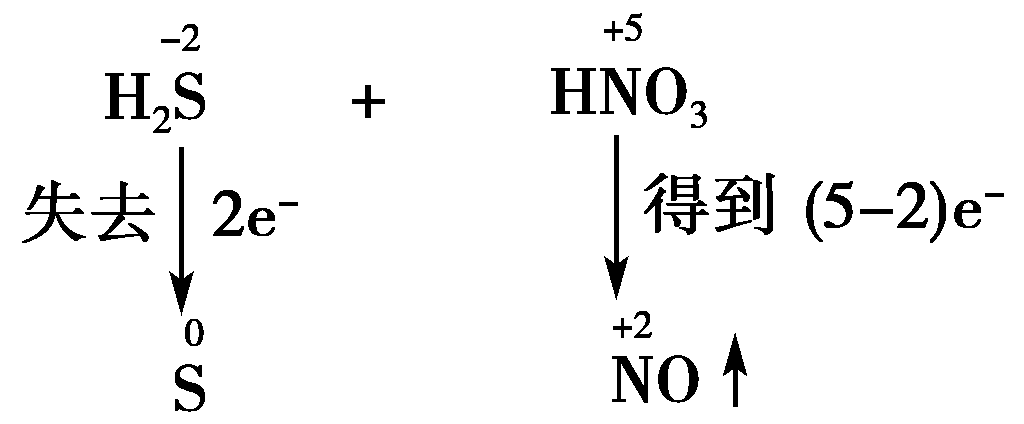
第三步:求总数。从而确定氧化剂(或还原产物)和还原剂(或氧化产物)的化学计量数。
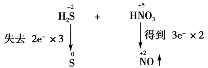
故H2S和S的化学计量数为3,NO和HNO3的化学计量数为2。
第四步:配系数。先配平变价元素,再利用原子守恒配平其他元素。
3H2S+2HNO3===3S↓+2NO↑+4H2O
第五步:查守恒。其他原子在配平时相等,最后利用O原子守恒来进行验证。
答案:3H2S+2HNO3===3S↓+2NO↑+4H2O
典例2. 缺项型的配平
将NaBiO3固体(黄色,微溶)加入MnsO4和H2SO4的混合溶液里,加热,溶液显紫色(Bi3+无色)。配平该反应的离子方程式:
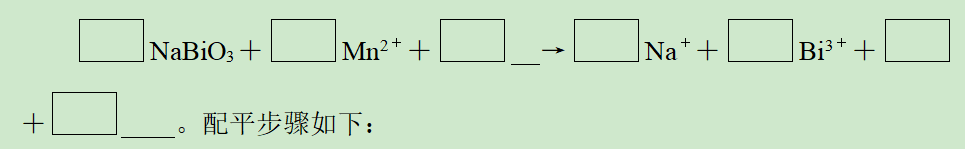
解析:(1)由溶液显紫色可推知有MnO4-生成,确定变价元素物质的化学计量数。
化合价分析如下:
Bi(+5→+3) 2× 5(化学计量数5配在NaBiO3和Bi3+前)
Mn(+2→+7) 5×2(化学计量数2配在Mn2+和MnO-4前)
(2)利用原子守恒确定缺项物质及其他物质的化学计量数。
5NaBiO3+2Mn2++ →5Na++5Bi3++2MnO4-+ 。
(3)据补项原则,在酸性条件下,方程式左边多O,故应补H+,而方程式右边少O,故应补H2O,再根据原子守恒配平H+和H2O之前的化学计量数。
答案:5NaBiO3+2Mn2++14H+===5Na++5Bi3++2MnO4-+7H2O。
典例3. 离子方程式的书写
写出酸性条件下MnO2与NaHSO3溶液反应的离子方程式是_____。
解析:第1步:MnO2+HSO3-―→Mn2++SO42-
第2步:Mn降低2价,S升高2价,故在MnO2、HsO3-前系数均为1:
MnO2+HSO3-―→Mn2++SO42-
第3步:方程式左边带1个负电荷,右边不带电荷,溶液显酸性,故在方程式左边添加1个H+使电荷守恒:MnO2+HSO3-+H+―→Mn2++SO42-
第4步:根据原子守恒在方程式右边加1个H2O:MnO2+HSO3-+H+===Mn2++SO42-+H2O
答案: MnO2+HSO3-+H+===Mn2++SO42-+H2O
典例4.直给信息型
(1)已知在酸性介质中FeSO4能将+6价铬还原成+3价铬。写出Cr2O72-与FeSO4溶液在酸性条件下反应的离子方程式:___________________。
(2)用NaClO 、-NaOH溶液氧化AgNO3,制得高纯度的纳米级Ag2O2。写出该反应的离子方程式:___________________。
(3)KMnO4氧化废水中Mn2+生成MnO2的离子方程式为_______________________。
(4)温度高于200℃时,硝酸铝完全分解成氧化铝和两种气体(其体积比为4∶1),该反应的化学方程式:______________________。
(5)利用石灰乳和硝酸工业的尾气(含NO、NO2)反应,既能净化尾气,又能获得应用广泛的Ca(NO2)2。生产中溶液需保持弱碱性。在酸性溶液中Ca(NO2)2会发生分解,产物之一是NO,反应的离子方程式:___________________________。
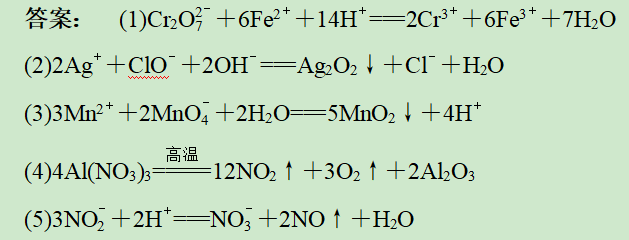
典例5.工艺流程型
(1)利用钴渣[含Co(OH)3、Fe(OH)3等]制备钴氧化物的工艺流程如下:
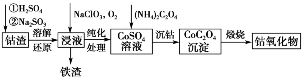
Co(OH)3溶解还原反应的离子方程式为_________________________。
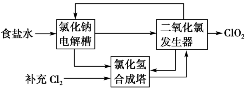
(2)二氧化氯(ClO2)是一种高效、广谱、安全的杀菌、消毒剂。氯化钠电解法是一种可靠的工业生产ClO2方法。该法工艺原理示意图如下。其过程是将食盐水在特定条件下电解得到的氯酸钠(NaClO3)与盐酸反应生成ClO2。发生器中生成ClO2的化学方程式为________。
答案: (1)2CO(OH)3+SO32-+4H+===2CO2++SO42-+5H2O
(2)2NaClO3+4HCl===2ClO2↑+Cl2↑+2NaCl+2H2O
实战演练
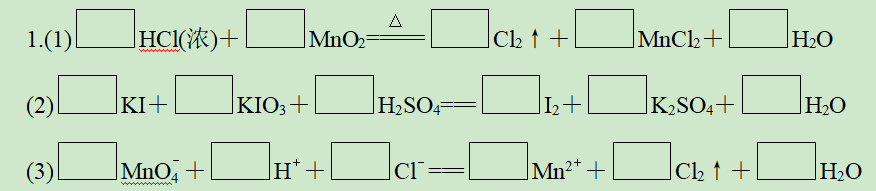
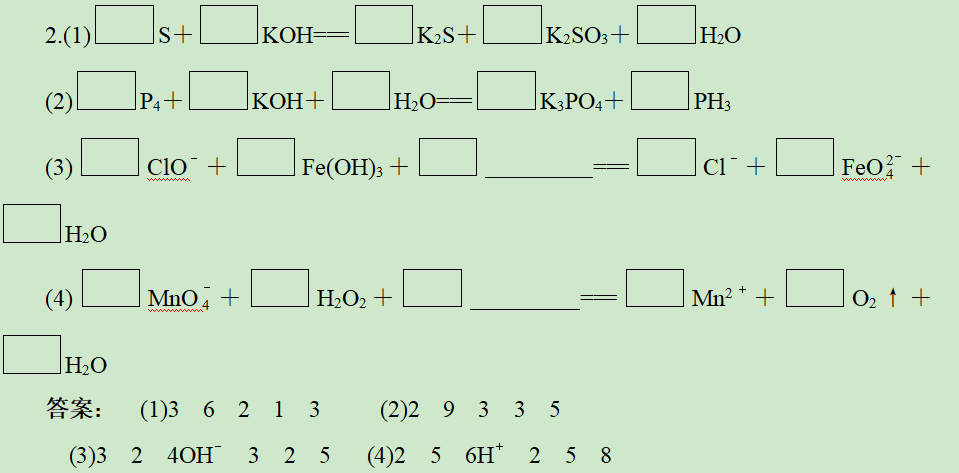
答案: (1)4 1 1 1 2(2)5 1 3 3 3 3(3)2 16 10 2 5 8

答案: Al2O3 3C N2 2 3CO
走近高考
[2020·北京等级考,17(3)(4)](3)HNO3-NaCl与王水[V(浓硝酸)∶V(浓盐酸)=1∶3]溶金原理相同。
①将溶金反应的化学方程式补充完整:
Au+ NaCl+ HNO3=HAuCl4+ + + NaNO3
②关于溶金的下列说法正确的是 。
A.用到了HNO3的氧化性
B.王水中浓盐酸的主要作用是增强溶液的酸性
C.用浓盐酸与NaNO3也可使Au溶解
(4)若用Zn粉将溶液中的1 mol HAuCl4完全还原,则参加反应Zn的物质的量是 mol。
答案: (3)①4 5 NO 2H2O 4 ②Ac (4)1·5

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
说明: 1.不同于大学所说的“氧化数”,高中所学的“化合价”...
氧化还原反应的很多规律,如化合价有升必有降、电子有得必有...
配平氧化还原反应方程式的基本方法相同,关键是针对具体的反...
氧化性、还原性的强弱主要取决于物质本身得失电子的难易程度...
得失电子守恒是氧化还原反应的核心,根据这一原理,既可配平...
1 问题的提出 “氧化还原反应”在中学化学知识中占据着关键性...