
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
元素氧化物的水化物M(OH)x在水溶液中有两种电离的可能性:
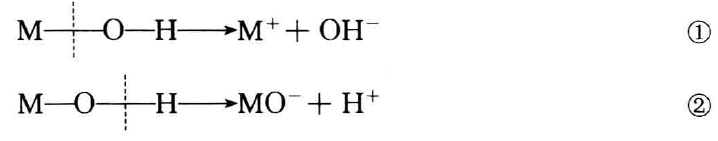
到底采取哪种电离方式,主要决定于分子内化学键的相对极性。
极性:M—O>O—H,按①式离解,MOH显碱性;O一H>M—O,按②式离解,MOH显酸性;如果M—O和O—H的极性相差不大,MOH为两性。
(1) M—O和O—H的极性相对强弱与M的电荷多少、半径大小有关。
如:
Na | Mg | Al | Si | P | S | Cl | |
化学式 | NaOH | Mg(OH)2 | Al(OH)3 | H2SiO3 | H3PO4 | H2SO4 | HClO4 |
M电荷(+ ) | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
M半径 | 0. 95 | 0. 65 | 0. 50 | 0.47 | 0. 34 | 0.29 | 0.27 |
如果M的电荷少,半径大,则M与O形成较强的极性键,M(OH)x在水中按碱式电离;
如果M的电荷多、半径小,则按酸式电离。
通过上表所列第三周期元素最高氧化物的水化物有关数据可见:M电荷依次递增,半径依次递减,碱式电离由强而弱,通过两性而递变为由弱而强的酸式电离。
如果M电荷多、半径小,则极化力强,M—O键的极性减弱, O—H键的极性相对变强,M(OH)x取酸式电离;反之,则取碱式 电离。因此,同一种金属其最高价氧化物的水化物是酸,而低价 氧化物的水化物是碱,就是其中心原子极化作用影响的结果。如 Mn(OH)2显碱性,HMnO4显酸性。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
把碘液滴加到淀粉当中,它们立刻就会形成墨水般的蓝黑色——...
苯的亲电取代反应定位规则是由许多实验事实中总结出来的经验...
分析:有机化学的学习中,经常用到高锰酸钾溶液。做试剂用时...
原子核外的电子排布,最外层不超过8个,次外层不超过18 个,这...
元素氧化物的水化物M(OH) x 在水溶液中有两种电离的可能性: 到底...
有机物普遍存在同分构现象, 大多数无机物的结构单一,所以无...