
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
化学反应进行的方向是新课程人教版化学教材在选修模 块中新增加的知识,《普通高中化学课程标准》只要求学生“能 用焓变和熵变说明化学反应进行的方向”,在《2012年高考全 国新课标(化学)考试大纲》中也没有专门要求,但它对于学习原电池的形成条件、化学反应发生的条件,解释某些化学性质等具有很好的指导作用。该知识点在大学《无机化学》和《物 理化学》中复杂难懂,髙中教材在编写时鉴于学生认知水平和 教材篇幅的原因,只简单地从三个层次进行了描述。首先用反 应的热效应焓变判断化学反应进行方向,当焓判据不能解释某 些吸热反应也能自发进行的时候提出了混乱度的概念,从而得出熵判据,最后根据一些熵减的过程也能自发进行总结出必须根据两个因素进行综合判断,即科学视野中介绍的自由能。教 材在难度上要求比较简单,但是由于对一些基本概念没做介绍,教师在教学以及学生在学习过程中都产生了一些误解,笔者在研读了大学《物理化学》《无机化学》和查阅一些资料的基 础上,对化学反应进行的方向在高中化学知识中的应用容易出现的误区进行解读,希望能帮助教师和学生解决一些疑问。
―、误区一:反应自发进行就是不需要任何条件都能发生
教材对自发进行没有完整的定义,只是有这样一句描述: “那些不用借助于外力就可以自动进行的自发过程的共同点 是,体系趋向于从高能状态转变为低能状态。”这句话让学生错误地认为不借助外力就是指不需要任何条件,因此学生会对氢气燃烧生成水的反应是自发反应产生疑问,认为点燃是给予了体系能量,是借助了外力,因此属于非自发反应。产生这种错误的原因在于对“外力作用”的理解,根据吉布斯对自发和非自发的定义:“凡是在理论上或者实际上能提供非体积功的过程都是自发过程,而由环境提供非体积功去使过程发生的过程是非自发的。”因此,这里的外力应该是功,并且是非体积功,比如电解时提供的电功,水泵将水从低处抽到高处的机械功,既不是因为体系体积变化而与环境所产生的功,更不是热。从热力学的角度看,热是体系与环境间存在温度差而使体系与环境间传递的能量,功则是体系变化过程中,体系与环境间除热以外的其他各种形式的传递的能量,体系以这两种不同的方式与环境交换能量。比如气态水,可以通过降温成为液态,也可以通过加压形成液态,前者是以热的方式与环境交换能量,后者是以功的形式与环境交换能量。环境提供给体系热量,不能说是对体系做功,即使在极低温时,环境和体系之间由于温度的不同也存在着能量的交换,比如液氮的气化,即使在-100℃时也 能吸收热量而自发进行。

由此可见,该反应的ΔG远小于零,在常温常压下不但不需要消耗非体积功,相反还能提供非体积功,比如在氢氧燃料电 池中就是通过自发反应将化学能转化为电能,即提供了电功, 这也是电池组成的一个必要条件,即为能自发进行的氧化还原反应。相反,常温常压下,水分解为氢气和氧气的自由能是增 加的,其过程是非自发的,必须要提供非体积功(电解是提供电功)才能完成。
二、误区二:持续加热的反应是非自发反应
某些教师在解释学生关于燃烧反应为什么是自发反应时, 往往会解释点燃只是一个条件,点燃之后反应就持续进行了, 所以燃烧是一个自发的过程。这会让学生产生一种误解,认为持续加热的反应就是非自发的反应。造成这种误区的原因,一是没有理解自发进行的含义,二是忽略了活化能这个能垒。
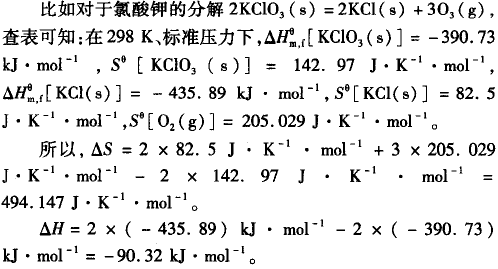
由此可见,该反应为熵增、焓减的反应,两个因素都是对自 发有利,根据ΔG=ΔH- TΔS,在任何温度下ΔG< 0,也就是说在任何温度下都是自发的,但由于反应放出的热量小于活化能的 “能垒”,反应需要在约380℃持续加热才能持续进行,但在合适的催化剂下,可以在比较低的温度下自发进行。
三、误区三:任意温度下反应均不自发就是不进行
对于ΔH为正值,ΔS为负值,即焓增、熵减的反应,无论温度多髙,ΔG总是大于零,因而反应总是不自发的,但不代表反应不发生,只是需要环境对体系提供非体积功。

变ΔG的正负值,ΔG始终为正值,因此在任意温度下,该反应都是不能自发进行的,但在放电条件下,这个反应就发生了。实验室利用对氧气无声放电来获得臭氧,家用臭氧消毒柜也是这个原理。
再比如石墨转化为金刚石,在298 K、标准压力C(石墨) =C (金刚石),ΔH = 1. 88 KJ • mol-1,ΔS =-3. 26 J • K -1 • mol-1。尽管反应热不大,但该反应是一个焓增、熵减的 反应,在任何温度下均不自发,但在高温克服活化能和髙压外力做功作用下,利用石墨可以制得金刚石。工业上正是以Co或Ni 为催化剂,在5 ×106KPa~6×106 KPa和1273 K的条件下,将石墨转化为金刚石的。
综上所述,温度高低不是判断自发性的依据,不管是高温还是低温条件下,环境和体系都可以有热的交换。因此不能说在高温下的反应就是非自发,而低温下的反应就是自发的。一 般来说,正向在任何温度下自发,逆向则是任何温度下均非自发。而对于焓熵同号的反应,比如焓减、熵减,正向低温自发, 则逆向为高温自发。如NH3(g) +HCl(g) =NH4C1(s),低温是反应正向自发,而髙温是NH4Cl自发分解为NH3和HCl。

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
化学反应的焓变越大,代表这个反应受温度变化的影响越大吗?...
活化分子百分数和活化分子数,理解它对掌握化学反应速率至关...
在化学热力学和分析化学中,我们常常听到这样的说法:“如果...
...
一、 什么是活化能? 活化能,通常用符号Ea表示,其标准单位为...
一、基本定义 (一)中间体 1、根据国际纯粹与应用化学联合会...