
|
学习小专题 |

|
学习小专题 |
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、反应焓变与反应方向
1.根据是否有外力作用,过程可分为自发过程和非自发过程。自发过程是在一定条件下,不借助外力而自发进行的过程。
自发过程具有的特点:
(1)体系趋向于从能量较高状态转变为能量较低状态(体系对外部做功或者释放热量)。
(2)在密闭条件下,体系有从有序自发转变为无序的倾向。
2.化学反应的自发性与反应焓变的关系
(1)放热反应:绝大多数都能自发进行,且反应放出的热量越多,体系能量降低得越多,反应越完全。
(2)吸热反应:有些也能自发进行。
(3)结论:反应的焓变是制约化学反应能否自发进行的因素之一。
微点拨:(1)非自发反应在一定条件下也能够进行。
(2)自发反应只说明了反应的方向性,不能说明反应实际是否发生,也不能说明反应的快慢。
二、反应熵变与反应方向
1.熵
(1)概念:衡量体系混乱度的物理量,其符号为S,单位为J·mol-1·K-1。
(2)特点:混乱度越大,体系越无序,体系的熵值就越大。
(3)影响因素
①同一物质:S(高温)>S(低温);S(g)>S(l)>S(s)。
②相同条件下的不同物质:分子结构越复杂,熵值越大。
③S(混合物)>S(纯净物)。
2、熵变
(1)概念:反应产物总熵与反应物总熵之差。
(2)计算式:ΔS=S(反应产物)一S(反应物)。
(3)正负判断依据
①物质由固态到液态、由液态到气态或由固态到气态的过程,ΔS>0,是熵增加的过程。
②气体体积增大的反应,熵变通常都是ΔS>0,是熵增加的反应。
③气体体积减小的反应,熵变通常都是ΔS<0,是熵减小的反应。
3.熵变与反应方向
(1)含义:大多数自发反应有趋向于体系混乱度增大的倾向,导致体系的熵增大。
(2)规律:大多数熵增加的反应都能自发进行。
(3)局限性:少数熵减少的反应在一定条件下也可以自发进行,如-10“C的液态水自动结冰、NH3(g)+HCl(g)一NH4Cl(s)。
(4)结论:熵变是影响反应自发进行的因素之一,但不是唯一因素。
熵增加的反应在常温、常压下一定能自发进行吗?而熵减小的反应是不是一定不能自发进行?试举例说明。
提示:不一定。碳酸钙分解为氧化钙和二氧化碳是熵增加的反应,但该反应需要高温才能自发进行。氯化氢与氨的化合反应是熵减小的反应,但该反应可以自发进行。
三、焓变与熵变对反应方向的共同影响
体系能量降低和混乱度增大都有促使反应自发进行的倾向。判断反应的自发性必须综合考虑反应的焓变和熵变。在恒温、恒压时,
(1)ΔH<0、ΔS>0,则反应一定能自发进行;
(2)ΔH>0、ΔS<0,则反应一定不能自发进行;
(3)ΔH<0、ΔS<0或ΔH>0,ΔS>0,反应可能自发进行,也可能不自发进行,与反应的温度有关。
四、化学反应进行方向的综合判据
1.焓变和熵变都与反应自发性有关,又都不能独立地作为反应自发性的判据,要判断反应进行的方向,必须综合考虑体系的焓变和熵变。可以利用以下公式进行判断,ΔH-TΔS。
ΔH-TΔS<0,反应能自发进行;
ΔH-TΔS=0,反应达到平衡状态;
ΔH-TΔS>0,反应不能自发进行。
2.四象限

典型例题:
1.判断正误(正确的打“√”,错误的打“×”)。
(1)能够自发进行的反应一定容易发生,也一定能反应完全。 ( )
(2)C(s)+CO2(g)===2CO(g),室温下不能自发进行,说明该反应的ΔH>0。 ( )
(3)一定条件下能正向自发进行的反应,其逆向必定不能自发进行。 ( )
(4)对于ΔS>0的反应,若在任何温度下均能自发进行说明ΔH>0。 ( )
答案:(1)×(2)√(3)√(4)×
2.下列关于判断反应的方向的说法正确的是( )
A.所有自发进行的化学反应都是放热反应
B.自发反应在任何条件下都能发生
C.由焓判据和熵判据组合而成的复合判据,将更适合于所有的反应
D.同一物质的固、液、气三种状态的熵值相同
解析:C[焓判据与熵判据都不能单独作为反应自发性的判据,二者组合而成的复合判据,更适合于所有的反应,A项错误,C项正确;在一定条件下能自发进行的反应,改变条件可能不能自发进行,B项错误;同一物质S(s)<S(l)<S(g),D项错误。]
3.(1)少量蔗糖溶解于水中,ΔS________0(填“>”或“<”,下同)。
(2)纯碳和氧气反应生成CO(g),ΔS________0。
(3)液态水蒸发变成水蒸气,ΔS________0。
答案:(1)> (2)> (3)>
4.下列反应在任意温度下一定能自发进行的是______(填序号)。
(1)2NaCl2 Na+Cl2↑
Na+Cl2↑
(2)2KClO3(s)===2KCl(s)+3O2(g) ΔH=-78.03kJ·mol-1
(3)CaCO3(s)===CaO(s)+CO2(g) ΔH=178.2kJ·mol-1
(4)4Fe(OH)2(s)+2H2O(l)+O2(g)===4Fe(OH)3(s) ΔH=-444.3kJ·mol-1
(5)CO(g)===C(s,石墨)+1/2O2(g) ΔH=110.5kJ·mol-1
解析:(1)反应需要通电才能进行,故该反应为非自发反应。(2)ΔH<0、ΔS>0,任意温度下都有ΔH-TΔS<0,故该反应任意温度下都能自发进行。(3)ΔH>0、ΔS>0,在高温下(T>ΔH/ΔS)时,ΔH-TΔS<0,反应能自发进行;而低温下(T<ΔH/ΔS)时,反应不能自发进行。(4)ΔH<0,ΔS<0,在低温下(T<ΔH/ΔS)时,ΔH-TΔS<0,反应能自发进行。(5)ΔH>0、ΔS<0,ΔH-TΔS>0,该反应任意温度下都不能自发反应。
答案:(2)
5.在化学反应A(g)+B(g)==2C(g)+D(g)ΔH=QkJ·mol-1过程中的能量变化如图所示,回答下列问题。
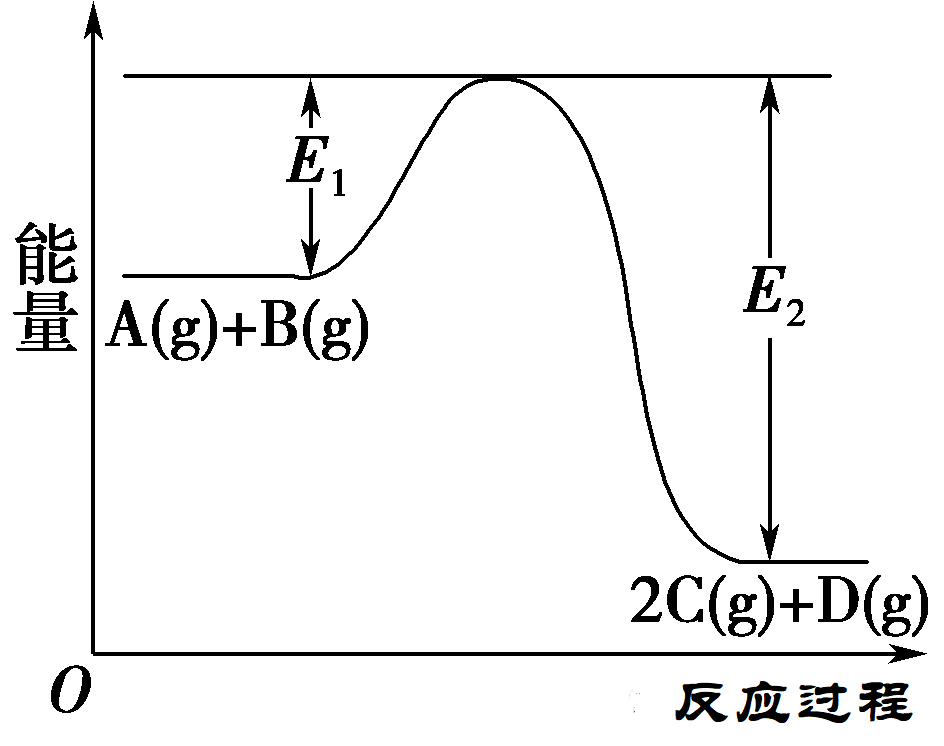
(1)Q________0(填“>”“<”或“=”)。
(2)熵变ΔS________0(填“>”“<”或“=”)。
(3)该反应________自发进行(填“能”或“不能”)。
解析:据图象可知,该反应是放热反应,故Q<0。据反应特点可知,该反应是熵增大的反应;据此可知该反应能自发进行。
答案:(1)<(2)>(3)能

 欢迎订阅网站动态,手机扫一扫就可以。
欢迎订阅网站动态,手机扫一扫就可以。
 欢迎使用化学自习室APP,扫码就可下载。
欢迎使用化学自习室APP,扫码就可下载。
【题记】如果把有机分子同分异构体的书写比作是拼积木,那么...
一、过滤 1、原理:根据固体的溶解度不同,将不溶性固体从溶...
一、什么是不饱和度 不饱和度又称缺氢指数或者环加双键指数,...
定义:有机物分子中位置等同的氢叫等效氢. 分子中等效氢原子一...
烃分子式的确定方法有很多,常用的有以下几种: 一、根据烃分...
由有机物的分子式可以快速计算出不饱和度。对于一般简单结构...